Lékařský expert článku
Nové publikace
Hypofyzární anémie (trpasličí vzrůst)
Naposledy posuzováno: 12.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
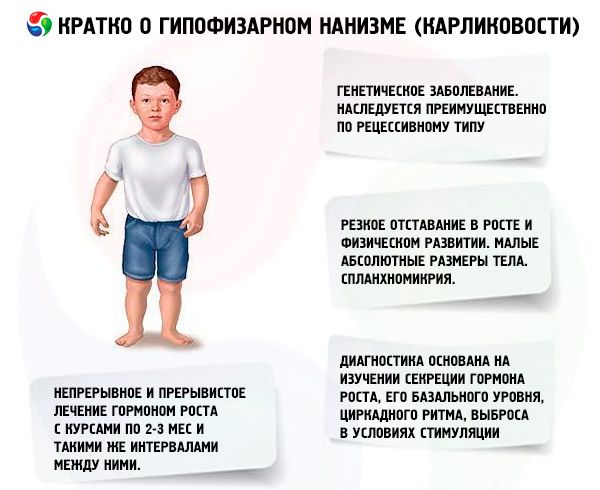
Termín „hypofyzární nanismus“ (z řeckého nanos - trpaslík; syn.: nanismus, nanosomie, mikrosomie) v absolutním smyslu znamená onemocnění, jehož hlavním projevem je prudké zpomalení růstu, spojené s porušením sekrece růstového hormonu přední hypofýzou.
V širším smyslu je nanismus poruchou růstu a fyzického vývoje, jejíž výskyt může být způsoben nejen absolutním nebo relativním nedostatkem somatotropního hormonu v důsledku patologie samotné hypofýzy, ale také poruchou hypotalamické (mozkové) regulace jejích funkcí, poruchami biosyntézy somatotropního hormonu a poruchami citlivosti tkání na tento hormon.
Příčiny zakrslost
Většina forem hypofyzárního nanismu jsou genetická onemocnění. Nejčastější je panhypopituitární nanismus, který se dědí převážně recesivně. Předpokládá se, že existují 2 typy přenosu této formy patologie - autozomálně a prostřednictvím chromozomu X. U této formy nanismu je spolu s poruchou sekrece somatotropního hormonu nejčastěji narušena sekrece gonadotropinů a hormonu stimulujícího štítnou žlázu. Sekrece ACTH je narušena méně často a v menší míře. Funkční studie s uvolňujícími hormony, včetně syntetického somatotropin uvolňujícího hormonu (sestávajícího z 29, 40 a 44 aminokyselinových zbytků), podobného pankreatickému polypeptidu, ukázaly, že většina těchto pacientů má patologii na úrovni hypotalamu a insuficience přední hypofýzy je sekundární. Primární patologie samotné hypofýzy je méně častá.
Genetický nanismus s izolovaným deficitem růstového hormonu, se zhoršenou biologickou aktivitou a citlivostí na něj, se sporadicky vyskytuje v Rusku a sousedních zemích. Častější je na americkém kontinentu, v zemích Blízkého a Středního východu a v Africe. Na základě výsledků studie obsahu somatotropního hormonu v krvi a citlivosti pacientů na exogenní somatotropní hormon, hladiny imunoreaktivního inzulínu (IRI), inzulinu podobných růstových faktorů (IGF) typu I (somatomedin C) a typu II a reakce IGF-1 na léčbu přípravky somatotropního hormonu byly identifikovány různé varianty klinicky podobných typů nanismu.
Nedávno byla rozluštěna patogeneze Laronova nanismu, který je způsoben deficitem IRF-1 a IRF-II, stejně jako patogeneze nanismu u afrických pygmejů, spojená s deficitem prvního z nich.
V roce 1984 byla popsána nová varianta pseudohypofyzárního nanismu s vysokou hladinou somatotropního hormonu a IGF-1; vznik nanismu je vysvětlen defektem jeho receptorů, což je dokázáno prudkým poklesem vazby kožních fibroblastů na IGF-1.
Je třeba zdůraznit, že v moderních podmínkách, s přítomností malých rodin, může být mnoho izolovaných („idiopatických“, sporadických) případů onemocnění také geneticky podmíněných.
Při analýze 350 kazuistik byla etiologie nanismu nejasná u 228 pacientů (65,2 %). Tato skupina zahrnovala pacienty z 57 rodin s opakovaným výskytem nanismu (2–4 případy na rodinu), což představovalo 28 % všech pacientů. U 77 % rodin s etiologicky nejasnými (většinou genetickými) formami nanismu byla zjištěna nepopiratelná souvislost s dědičností absence Rh faktoru. Distribuce Rh faktoru v rodinách pacientů s nanismem se liší od distribuce pozorované u Rh konfliktu mezi matkou a plodem a zpravidla není doprovázena hemolytickou chorobou novorozence (otec může být Rh negativní, a v případě heterozygotnosti rodičů pro Rh faktor – i děti atd.). Lze předpokládat souvislost mezi aktivitou genů zodpovědných za syntézu somatotropního hormonu (nebo hormonu uvolňujícího somatotropin) a geny určujícími Rh faktor, zejména proto, že většina forem nanismu a absence Rh faktoru jsou autozomálně recesivní znaky. To nevysvětluje relativní vzácnost nanismu ve srovnání s četností Rh-negativních jedinců v populaci. Pravděpodobně jsou důležité některé dosud neznámé další faktory, ale rysy distribuce Rh faktoru v rodinách pacientů s familiárním a sporadickým nanismem pravděpodobně nejsou náhodné.
Velkou skupinu pacientů s nanismem (primárním mozkovým, mozkově-hypofyzárním) tvoří pacienti s různými typy organické patologie centrálního nervového systému, která vznikla v děloze nebo v raném dětství. Anatomickým substrátem, který tuto patologii způsobuje, může být nedostatečný vývoj nebo absence hypofýzy, její dystopie při patologii tvorby turecké sella, cystická degenerace hypofýzy, její atrofie v důsledku komprese nádorem (kraniofaryngeom, chromofobní adenom, meningeom, gliom). Nanismus může být způsoben traumatickými poraněními hypotalamo-hypofyzární oblasti (intrauterinními, porodními nebo postnatálními), které se často vyskytuje u vícečetných těhotenství, stejně jako během porodu v poloze pánevní, v poloze na noze nebo v příčné poloze s rotací na noze (to je mechanismus porodu u více než 1/3 pacientek s nanismem). Významná jsou infekční a toxická poškození (intrauterinní virové infekce, tuberkulóza, syfilis, malárie, toxoplazmóza; onemocnění v raném věku, novorozenecká sepse, meningo- a arachnoencefalitida atd.). Tyto procesy mohou poškodit samotnou hypofýzu, hypotalamická centra, která regulují její funkci, a narušit normální funkční spojení v centrálním nervovém systému.
Intrauterinní léze plodu mohou vést k narození pacientů s „trpasličím vzrůstem od narození“ s normální sekrecí růstového hormonu (cerebrální primordiální trpasličí vzrůst, mikrocefalie, Silver-Russellův trpasličí vzrůst s tělesnou hemiasymetrií a vysokými hladinami gonadotropinů atd.).
Dalšími faktory, které zhoršují narušení fyzického vývoje u nanismu, mohou být nedostatečná výživa, nevyvážená z hlediska esenciálních složek (nedostatek bílkovin) a mikroelementů (nedostatek zinku), nepříznivé podmínky prostředí a také různá chronická onemocnění, jako je glomerulonefritida, při které azotemie ovlivňuje aktivitu jaterních receptorů nebo přímo ovlivňuje metabolismus jaterních buněk, což způsobuje snížení syntézy somatomedinu, nebo cirhóza jater, kdy je tvorba somatomedinu narušena.
Patogeneze
U většiny pacientů s hypofyzárním nanismem se změny neomezují pouze na patologii sekrece somatotropního hormonu a citlivost na něj, ale rozšiřují se i na další tropní hormony hypofýzy, což způsobuje různé kombinace endokrinních a metabolických poruch.
U izolovaného deficitu somatotropního hormonu byly morfologické změny v hypofýze málo prozkoumány. Ve studovaných případech byly patologické poruchy zjištěny jen zřídka (kraniofaryngeom nebo hyperostóza lebečních kostí). U tohoto typu nanismu lze pozorovat vrozené nedostatečné vývoje peptidergních buněk nebo defekt neurotransmiterního systému v hypotalamu. V takových případech může být nanismus kombinován s dysplazií nebo hypoplazií zrakových nervů. Intraselární cysty, nádory hypofýzy a hypotalamu vedou k deficitu STH, což způsobuje kompresi tkáně hypofýzy, zejména somatotropů.
Trpasličí vzrůst se vyznačuje ztenčováním kostí, zejména v důsledku kortikální vrstvy, opožděnou diferenciací a osifikací kostry. Vnitřní orgány jsou hypoplastické, někdy atrofické a svaly jsou špatně vyvinuté.
Symptomy zakrslost
Prudké zpoždění v růstu a fyzickém vývoji jsou hlavními projevy hypofyzárního nanismu. Pacienti se rodí s normální tělesnou hmotností a výškou a začínají zaostávat v růstu od 2. do 4. roku věku.
Před příchodem aktivní léčby nanismu byli za trpaslíky považováni ti s výškou menší než 120 cm u žen a 130 cm u mužů. V současné době se výška trpaslíka liší nejméně o 2-3 sigma odchylky od průměrné tabulkové normy pro dané pohlaví, věk nebo populaci. Existuje také metoda pro grafické posouzení výšky na základě Gaussovy distribuční křivky. V tomto případě jsou trpaslíci podle výšky zařazeni do skupiny, která zahrnuje minimální počet jedinců v odpovídající populaci s největším zpožděním od průměrné růstové normy.
Hypofyzární nanismus se vyznačuje nejen malou absolutní velikostí těla, ale také malou roční dynamikou růstu a fyzického vývoje. Stavba těla je proporcionální, ale proporce těla pacientů jsou typické pro dětství. Kůže je bledá, často s nažloutlým odstínem, suchá, což je způsobeno absolutní nebo relativní nedostatečností štítné žlázy, někdy se pozoruje cyanóza - "mramorování" kůže. U neléčených pacientů se brzy objevuje stařecky vypadající a vrásčitá kůže (gerodermie). To je způsobeno nedostatečností anabolického účinku STH a pomalou změnou buněčných generací.
Vlasy na hlavě mohou být normální nebo suché, řídké, křehké; typické jsou dlouhé řasy. Sekundární růst vlasů často chybí. Velikost turecké sella u většiny pacientů s nanismem (70-75 %) se nemění, ale sella si často zachovává dětský tvar „stojatého oválu“, má široký „juvenilní“ hřbet, sinus sfénoidní kosti zaostává z hlediska pneumatizace. Existují však pacienti se zvětšenou turckou sella, což je známkou nádoru; s oblastmi kalcifikace na jejím pozadí nebo v oblasti vchodu (s kraniofaryngeomem, zbytkovými účinky neuroinfekce) nebo jejím zmenšením (známky nedostatečného vývoje, malá velikost hypofýzy). Pozorují se příznaky intrakraniální hypertenze: ztenčení kostí lebeční klenby, zvýšený cévní vzor, přítomnost otisků prstů atd. Nejdůležitějším znakem nanismu hypofýzy je zpoždění v načasování diferenciace a osifikace kostry. S diferenciací skeletu úzce souvisí i rysy zubního systému: je zaznamenána pozdní výměna mléčných zubů. Největší zpoždění ve vývoji kosterního systému je pozorováno u pacientů s nanismem se sexuální insuficiencí a hypotyreózou.
Genitálie většiny pacientů jsou silně nedostatečně vyvinuté, ačkoli malformace jsou vzácné. Kryptorchismus jsme pozorovali u 5,8 % mužských pacientů. Sexuální insuficience je doprovázena nedostatečným vývojem sekundárních pohlavních znaků a sníženou sexuální touhou, absencí menstruace. Normální spontánní pohlavní vývoj je pozorován pouze u pacientů s izolovaným deficitem růstového hormonu a u některých pacientů s mozkovým nanismem.
Nedostatečnost štítné žlázy je poměrně častým příznakem nanismu. Je třeba poznamenat, že vnější projevy hypotyreózy ne vždy odrážejí skutečný funkční stav štítné žlázy. To je způsobeno relativní hypotyreózou v důsledku porušení přechodu tyroxinu (T4 ) na trijodtyronin (T3 ) a tvorby inaktivního (reverzibilního) T3 , což je charakteristické pro somatotropní insuficienci.
Adrenokortikotropní funkce u hypofyzárního nanismu klesá méně často a v menší míře než pohlavní a tyreostimulační funkce a u většiny pacientů nevyžaduje speciální korekci.
Ve většině případů není intelekt narušen. Vyskytují se emoční změny ve formě mentálního infantilismu; u starších pacientů bez intelektuálního postižení se někdy pozorují reaktivní neurózy.
U organické mozkové patologie, zejména nádorové, se může vyskytnout nanismus s příznaky diabetes insipidus, bitemporální hemianopsie a mentálního postižení.
Studie vývoje bioelektrické aktivity mozku u pacientů bez organických příznaků centrálního nervového systému ukázala, že jejich EEG se vyznačuje rysy nezralosti, dlouhodobým zachováním vysokého „dětského“ EEG napětí; nerovnoměrností alfa rytmu v amplitudě a frekvenci; prudkým nárůstem obsahu pomalých θ- a δ-rytmů, zejména ve frontálních a centrálních svodech; zřetelnou reakcí na hyperventilaci; posunem rozsahu EEG rytmů po rytmech světelné stimulace směrem k nízkým frekvencím (důkaz snížení funkční mobility nervových struktur mozku). Bylo zjištěno, že u starších pacientů je nezralá povaha elektrické aktivity mozku způsobena sexuálním nedostatečným vývojem a u pacientů všech věkových skupin hypotyreózou.
Metabolismus sacharidů u pacientů s nanismem je charakterizován tendencí ke snížení hladiny glukózy v krvi nalačno, jejím zvýšením během fyzické námahy, nedostatečností endogenního inzulínu, zvýšenou citlivostí na exogenní inzulín s častým rozvojem hypoglykemických stavů. To je vysvětleno především nedostatečnou hladinou kontrainzulárních hormonů v těle pacientů.
Vnitřní orgány vykazují splanchnomykrii, tj. zmenšení své velikosti. Nebyly popsány žádné funkční změny vnitřních orgánů specifické pro nanismus. Často je pozorována arteriální hypotenze se sníženým systolickým a diastolickým tlakem a sníženou amplitudou pulzu. Srdeční ozvy jsou tlumené, jsou slyšet funkční šelesty různé tematiky v důsledku trofických změn v myokardu a autonomních poruch. EKG je charakterizováno nízkou voltáží (zejména při přítomnosti hypotyreózy), sinusovou bradykardií nebo bradyarytmií; PCG ukazuje pokles amplitudy tónů, další tóny a funkční šelesty. Data oxygemometrie naznačují hypoxémii (počáteční a během fyzické námahy) a kyslíkový dluh. U starších pacientů se někdy vyvine hypertenze.
Diagnostika zakrslost
Diagnóza a diferenciální diagnostika nanismu je založena na anamnéze a komplexním klinickém, radiologickém, laboratorním a hormonálním vyšetření. Kromě absolutní velikosti těla se pro posouzení růstu pacientů stanovuje růstový deficit - rozdíl mezi výškou pacienta a jeho průměrnou normou pro odpovídající pohlaví a věk; růstový věk - soulad výšky pacienta s určitými normami; ukazatel normalizované odchylky
I = M - Mcp / δ, kde M je výška pacienta, Mcp je průměrná normální výška pro dané pohlaví a věk, δ je kvadratická odchylka od Mcp; I menší než 3 je typické pro nanismus, I větší než 3 je typické pro gigantismus. Tento ukazatel lze použít k posouzení dynamiky vývoje.
Rentgenové vyšetření pacientů s nanismem odhaluje známky intrakraniální hypertenze, zbytkové účinky neuroinfekce, kalcifikace a kraniosynostózy. Studium velikosti, tvaru a struktury turecké sella je považováno za nepřímý ukazatel charakterizující velikost hypofýzy. Jedním z nejdůležitějších projevů patologické růstové retardace je porušení kosterní diferenciace. Pro posouzení stupně kosterní zralosti se stanoví kostní (rentgenový) věk, který odpovídá diferenciaci kostní tkáně; deficit osifikace je stupeň zpoždění osifikace od normy (v letech), koeficient osifikace je podíl dělení kostního věku chronologickými a dalšími parametry.
Moderní diagnostika nanismu je nemožná bez studia sekrece somatotropního hormonu, jeho bazální hladiny, cirkadiánního rytmu a uvolňování při stimulaci. Většina pacientů s hypofyzárním nanismem se vyznačuje sníženým obsahem somatotropního hormonu v krevním séru. Při stanovení radioimunologickou metodou se pohybuje (podle různých autorů) od (0,87±0,09) do (1,50±0,64) ng/ml s průměrnou normou (3,81±0,29) ng/ml. Studie denních (cirkadiánních) rytmů sekrece somatotropního hormonu ukázala, že jeho hladina u zdravých lidí je maximální během prvních 2 hodin spánku a mezi 4. a 6. hodinou ranní. U nanismu je obsah somatotropního hormonu v těchto hodinách také snížen.
Ke studiu rezerv somatotropní funkce se používají různé stimulanty, přičemž se zkoumá obsah somatotropního hormonu před a po jejich podání. Krev pro vyšetření se odebírá každých 30 minut po dobu 2-3 hodin. Uvolňování somatotropního hormonu po stimulaci se považuje za normální alespoň do 7-10 ng/ml, někdy dosahuje 20-40 ng/ml. Pokud v jednom ze vzorků nedojde k žádné reakci, provedou se opakované testy s jinými stimulanty. Nedostatek somatotropního hormonu se považuje za prokázaný, pokud se somatotropní hormon neuvolní ve 2-3 různých vzorcích.
Nejčastěji používané stimulační testy jsou: s intravenózním podáním 0,1 U (0,75-1,5 U) inzulinu na 1 kg tělesné hmotnosti pacienta a dosažením hypoglykémie (pokles hladiny glukózy v krvi o 50 % oproti počáteční hladině) se sérový somatotropní hormon stanoví podle výše uvedeného schématu. Pokud se rozvine těžká hypoglykémie, test se přeruší a pacientovi se intravenózně podá glukóza. Jedná se o nejběžnější klasickou diagnostickou metodu.
TRH v dávce 200-500 mcg intravenózně. Účinně identifikuje hormonální rezervy, nezpůsobuje komplikace. V kombinaci s inzulínovým testem umožňuje posoudit stupeň poškození hypotalamo-hypofyzárního systému. Pozitivní reakce na TRH při absenci inzulínové hypoglykémie naznačuje neporušenost hypofýzy a poškození na hypotalamické úrovni, negativní reakce na TRH a hypoglykémie naznačují poškození samotné hypofýzy.
TRH, LH-RH v dávce 300 mcg intravenózně je podobný jako předchozí.
Lidský SGH je syntetický analog biologicky aktivní sloučeniny izolované z nádoru slinivky břišní. V současné době existují 3 typy syntetického SGH: s 29, 40 a 44 aminokyselinovými zbytky. Používá se intravenózně v dávkách od 1 do 3 μg/kg tělesné hmotnosti pacienta. Uvolňování STH je pozorováno 15-20 minut po podání, test je účinnější než jiné při odhalování rezerv endogenního růstového hormonu. Pozitivní reakce SGH indikuje hypotalamickou úroveň poškození somatotropní funkce a intaktní hypofýzu; s aminokyselinami (L-arginin monochlorid, ornithin, tryptofan, glycin, leucin) intravenózně v dávce 0,25-0,5 g na 1 kg tělesné hmotnosti pacienta. Účinný pro studium rezerv SGH. Může způsobit alergické reakce.
L-dopa perorálně v dávce 250-500 mcg. Účinná, pacienty dobře snášená.
Používají se také testy s glukagonem, bromergokryptinem (parlodel), lysinvasopresinem, klonidinem a dávkovanou zátěží na kole.
Studium stavu somatotropní funkce je nezbytné nejen pro diagnózu nanismu, ale také pro odůvodněnou volbu metody terapie, protože léčba somatotropinem je racionální pouze v případě nedostatečnosti endogenního růstového hormonu.
Pro diagnózu formy nanismu je velmi důležité studovat obsah inzulinu podobných růstových faktorů neboli somatomedinů (zejména IGF-1 neboli somatomedin C) - mediátorů účinku somatotropního hormonu na tkáňové úrovni. Je známo, že obsah somatomedinu C je u nanismu snížený a u akromegalie zvýšený ve srovnání s normou. Forma nanismu popsaná Laronem je typ onemocnění s normální produkcí STH, ale s poruchou tvorby IGF-1 a IGF-II. Léčba těchto pacientů somatotropinem je marná.
Nepřímými ukazateli somatotropní funkce hypofýzy jsou aktivita alkalické fosfatázy a obsah anorganického fosforu v séru. V hyposomatotropních stavech jsou tyto ukazatele sníženy. U panhypopituitární formy nanismu je snížena sekrece gonadotropinů, často TSH, což je doprovázeno odpovídajícím snížením funkcí pohlavních žláz (nedostatek androgenů nebo estrogenů), štítné žlázy (snížení hladin T3 , T4 , jódu vázaného na proteiny - PBI, akumulace 131I štítnou žlázou) a nadledvin (snížení množství kortizolu a 17-OCS v plazmě, vylučování 17-KC a 17-OCS močí, lymfocytóza).
Všechny typy hypothalamo-hypofyzárního genetického nanismu jsou charakterizovány opakovaným onemocněním dětí v rodině s dědičností autozomálně recesivním (častěji) nebo autozomálně dominantním typem, retardací růstu a fyzického vývoje od 2 do 4 let se zpožděním alespoň 2-3 ° od průměrných růstových norem pro dané pohlaví, věk, populaci, s nízkou spontánní roční dynamikou růstu, opožděnou osifikací. Při nízké hladině somatotropního hormonu (ve 2-3 stimulačních testech pod 7 ng/ml) je terapie somatotropním hormonem vysoce účinná (vede k nárůstu výšky alespoň o 7 cm za rok). Při normální nebo vysoké hladině somatotropního hormonu (s jeho biologickou neaktivitou) může být citlivost na hormon zachována. Nejsou pozorovány žádné změny v inteligenci.
U genetického nanismu s necitlivostí tkání na somatotropní hormon je klinický obraz podobný izolovanému deficitu růstového hormonu, ale terapie somatotropinem je neúčinná. V této skupině lze podle hladiny IRF rozlišit následující hlavní formy: s normálním obsahem (defekt receptoru IRF) a snížený - nanismus typu Laron (deficit IRF-1 a IRF-II) a typ vyskytující se u afrických trpaslíků (deficit IRF-1).
Cerebrální nanismus je charakterizován izolovanými onemocněními v rodině spojenými s intrauterinním nebo postnatálním poškozením centrálního nervového systému, s přítomností zjevných organických změn v centrálním nervovém systému, často v kombinaci s patologií zrakového orgánu, přítomností diabetes insipidus, zachováním gonadotropních funkcí a změnami inteligence.
Některé typy gonádové dysgeneze a agenéz jsou doprovázeny výrazně nízkým vzrůstem, zejména Šereshevského-Turnerův syndrom a „turneroidní“ (mozaiková) forma syndromu testikulární dysgeneze. Cytogenetické studie (pohlavní chromatin, karyotyp) pomáhají v diferenciální diagnostice, odhalují chromozomální defekty, stejně jako charakteristické defekty somatického a pohlavního vývoje, normální nebo zvýšené hladiny endogenního somatotropního hormonu a necitlivost na léčbu somatotropinem.
Mezi endokrinními poruchami, které se vyskytují u nízkého vzrůstu, je třeba vyzdvihnout primární hypotyreózu způsobenou vrozenou hypoplazií nebo aplazií štítné žlázy, její dystopií, enzymatickými poruchami biosyntézy hormonů štítné žlázy a časným autoimunitním poškozením štítné žlázy. U všech těchto stavů dominují známky hypotyreózy s vysokou hladinou TSH a snížením hladiny T4 a T3 v krevním séru. U myxedému autoimunitní geneze jsou v krvi detekovány protilátky proti tyreoglobulinu, mikrozomálním a jaderným frakcím tkáně štítné žlázy a hladina somatotropního hormonu je normální nebo snížená. Klinického účinku lze dosáhnout pouze kompenzací hypotyreózy.
Nízký vzrůst je doprovázen předčasným pohlavním vývojem a adrenogenitálním syndromem v důsledku časného uzavření růstových zón; Itsenko-Cushingova choroba, která se vyskytuje v dětství v důsledku inhibičního účinku glukokortikoidů na sekreci somatotropního hormonu a jejich katabolického účinku; Mauriacův syndrom - nízký vzrůst a infantilismus pacientů s těžkým diabetes mellitus závislým na inzulínu.
Hypofyzární nanismus je třeba odlišovat od somatogenního zpoždění fyzického vývoje způsobeného chronickými metabolickými poruchami (u onemocnění jater, ledvin, gastrointestinálního traktu), chronickou hypoxií (u onemocnění kardiovaskulárního a dýchacího systému, u anémie); se systémovými onemocněními pohybového aparátu (chondrodystrofie, nedokonalá osteogeneze, exostóza) atd.
Funkční (konstituční) růstová retardace je někdy pozorována s pozdním nástupem puberty u zdánlivě zdravých dospívajících; zjistili jsme, že je primárně spojena s přechodnou nedostatečností gonadotropní aktivity. Sekrece somatotropního hormonu obvykle není narušena nebo je mírně snížena. Stimulace gonadotropinů může urychlit jak pohlavní vývoj, tak růst.
Nízký vzrůst rodinného charakteru by měl být považován za variantu fyziologického vývoje.
Co je třeba zkoumat?
Jak zkoušet?
Jaké testy jsou potřeba?
Kdo kontaktovat?
Léčba zakrslost
Léčba nanismu je dlouhý proces. To nutí lékaře rozložit prostředky k ovlivnění růstu v čase, aby se dosáhlo co největšího klinického účinku při dodržování 2 základních principů:
- maximální přiblížení vývoje vyvolaného léčbou k fyziologickým podmínkám;
- šetřící epifyzární růstové zóny.
Dlouholeté zkušenosti s léčbou nanismu nám umožňují považovat následující schéma etapové terapie za vhodné. Diagnóza nanismu u dospělých pacientů obvykle nevzbuzuje pochybnosti. U malých dětí je při nejasném klinickém obrazu nutné diagnostické období: 6-12 měsíců pod dohledem bez hormonální terapie. Během této doby je předepsána komplexní celková posilující léčba; dostatečná výživa se zvýšením obsahu živočišných bílkovin, zeleniny a ovoce ve stravě, vitamínů A a D, přípravků vápníku a fosforu. Absence dostatečných změn v růstu a fyzickém vývoji na tomto pozadí a zjištění endokrinních poruch během vyšetření jsou základem pro zahájení hormonální terapie.
Hlavním typem patogenetické terapie hypofyzárního nanismu je použití lidského růstového hormonu, protože výskyt většiny případů nanismu nepochybně závisí na té či oné formě jeho nedostatku. Vzhledem k druhové specifičnosti tohoto hormonu je pro člověka účinný pouze lidský a primátní somatotropin. V klinické praxi se široce používá lék izolovaný z hypofýzy lidí, kteří zemřeli na neinfekční a nenádorová onemocnění. Lidský somatotropin se získává bakteriální syntézou za použití Escherichia coli pomocí genetického inženýrství. Lidský somatotropin se syntetizuje také chemicky, ale je extrémně drahý a v klinické praxi se prakticky nepoužívá. Pro léčbu somatotropinem jsou vybíráni pacienti s prokázaným deficitem endogenního růstového hormonu, u kterých kosterní diferenciace nepřesahuje úroveň typickou pro 13-14leté děti. Pro léčbu neexistují žádná věková omezení.
Minimální účinné dávky, které lze použít v prvním období léčby, jsou 0,03–0,06 mg/kg tělesné hmotnosti. Nejúčinnější dávky jsou 2–4 mg 3krát týdně. Zvýšení jednorázové dávky na 10 mg nebylo doprovázeno adekvátním zvýšením růstového účinku, ale způsobilo rychlou tvorbu protilátek proti somatotropinu.
V naší zemi probíhá studium lidského růstového hormonu od roku 1960. Byly testovány dva léčebné režimy: kontinuální a intermitentní s 2-3měsíčními kúrami a stejnými intervaly mezi nimi. Průměrný nárůst výšky pacientů během 1. roku léčby byl 9,52±0,39 cm, nárůst tělesné hmotnosti byl 4,4±0,14 kg. Při dlouhodobé kontinuální léčbě byl průměrný nárůst výšky 0,82 cm/měsíc, tělesné hmotnosti 0,38 kg/měsíc; při intermitentní léčbě 0,75 cm/měsíc a 0,4 kg/měsíc. Kontinuální léčba poskytla rychlejší nárůst výšky s prudkým poklesem účinku po 1-1,5 roce, při intermitentní léčbě byla účinnost udržována po dobu 3-4 let, což nám umožňuje považovat cyklický léčebný režim za vhodnější. Stanovení hladiny IGF-I (somatomedinu C) může sloužit jako spolehlivý ukazatel citlivosti pacienta na léčbu somatotropiny. Zvýšení obsahu IGF-I po zavedení somatotropního hormonu umožňuje předpovědět pozitivní účinek terapie. Důležitou výhodou léčby somatotropinem je absence zrychlení osifikace skeletu na jejím pozadí.
Nejdůležitějším prostředkem léčby nanismu je užívání anabolických steroidů, které stimulují růst zvýšením syntézy bílkovin a zvýšením hladiny endogenního somatotropního hormonu. Léčba se provádí po dobu několika let s postupnou náhradou některých léků jinými, od méně aktivních k aktivnějším sloučeninám. Změna anabolických léků je indikována, když se růstový účinek po 2-3 letech sníží, což vede k dalšímu zvýšení růstu. Léčba se provádí v kúrách (doba odpočinku by měla být poloviční než doba léčby). V případě závislosti jsou indikovány i delší přestávky (až 4-6 měsíců). Současně se předepisuje pouze jeden z anabolických steroidů. Kombinace 2 nebo více léků je nevhodná, protože se tím nezesilují jejich metabolické a růstové účinky. Ty závisí především na věku pacientů a stupni diferenciace kosterních kostí na začátku léčby. Nejlepší účinek je pozorován u pacientů mladších 16-18 let s osifikací skeletu nepřesahující úroveň charakteristickou pro 14letého dítěte. Léčbu je vhodné zahájit ihned po stanovení diagnózy, obvykle od věku 5-7 let. Před léčbou je nutné se vyhnout předepisování gonadotropinů a pohlavních hormonů, které sice stimulují růst, ale zároveň urychlují diferenciaci skeletu. Princip dávkování anabolických steroidů je od minimálních účinných dávek k postupně se zvyšujícím. Doporučené dávky nejběžnějších léků: nerobol (metandrostenol, dianabol) - 0,1-0,15 mg na 1 kg tělesné hmotnosti denně perorálně; nerobolil (durabolin) - 1 mg na 1 kg tělesné hmotnosti měsíčně intramuskulárně, měsíční dávka se podává ve 2-3 dávkách po 15 nebo 10 dnech; retabolil (deka-durabolin) - 1 mg na 1 kg tělesné hmotnosti jednou měsíčně intramuskulárně. Překročení stanovených dávek může vést k androgenizaci. Ve fyziologických dávkách tyto sloučeniny významně neovlivňují stav genitálií a diferenciaci kostí, což umožňuje jejich dlouhodobé užívání u pacientů obou pohlaví. Dívky by měly být pod dohledem gynekologa, protože v případě předávkování nebo zvýšené individuální citlivosti se u některých pacientek mohou objevit známky virilizace, které po ukončení léčby rychle ustoupí. Perorální léky methylované na ethylované v 17. pozici mohou někdy způsobit cholestatický účinek, proto by u onemocnění jater měla být dána přednost parenterálním anabolickým sloučeninám nebo by měly být perorální léky kombinovány s choleretiky. Velmi vzácně může léčba anabolickými steroidy způsobit alergické reakce (svědění, vyrážky). Při absenci komplikací se anabolické steroidy používají tak dlouho, dokud je pozorován růstový efekt (do 16-18 let, někdy i déle). Léčba se provádí na pozadí celkově posilující terapie.
Pokud mají pacienti známky hypotyreózy, předepisují se současně léky na štítnou žlázu (tyroxin, tyreoidin, tyreoidea) v individuálně zvolených dávkách.
V léčbě chlapců je dalším krokem podávání lidského choriového gonadotropinu. Tento lék se používá nejdříve v 15-16 letech, často i v pozdějším věku ke stimulaci Leydigových buněk, což urychluje jak pohlavní vývoj, tak růst (díky anabolické aktivitě vlastních androgenů). Dávky 1000 až 1500 IU se používají 1-2krát týdně intramuskulárně v 2měsíčních kúrách maximálně 2-3krát ročně. Pokud je účinek neúplný, léčba lidským choriovým gonadotropinem u chlapců ve věku 16 let a starších se střídá s podáváním malých dávek androgenů (methyltestosteron v dávce 5-10 mg/den sublingválně).
Dívky starší 16 let mohou zahájit léčbu malými dávkami estrogenů, simulujícími normální sexuální cyklus. Léčba se provádí po dobu 3 týdnů v měsíci, po kterých následuje přestávka. Ve 2. fázi cyklu, od 3. týdne, lze předepsat choriový gonadotropin v dávce 1000-1500 IU 3-5krát týdně nebo léky s gestagenním účinkem (pregnin, progesteron).
Poslední fází léčby (po uzavření růstových zón) je neustálé podávání terapeutických dávek pohlavních hormonů odpovídajících pohlaví pacienta, aby se plně rozvinuly genitálie, sekundární pohlavní znaky, zajistilo libido a sexuální potence. Pro léčbu pacientek jsou vhodné kombinované estrogen-progestogenní přípravky (non-ovlon, bisekurin, infekundin, rigevidon) a pro léčbu mužských pacientů jsou vhodné androgenní přípravky s prodlouženým uvolňováním (testenát, sustanon-250, omnadren-250).
Provádí se celková posilující léčba (režim, proteinovo-zeleninová dieta, vitamínová terapie, biostimulanty). Indikováno je použití zinkových přípravků, v jejichž mechanismu účinku hraje hlavní roli zvýšení aktivity IGF-1 (inzulínu podobného růstového faktoru I).
V přítomnosti organické patologie centrálního nervového systému se podává protizánětlivá, resorpční a dehydratační terapie. Cílená systematická terapie má povzbudivý účinek. V důsledku dlouhodobé stupňovité léčby se 148 (80,4 %) ze 175 pacientů s nanismem obou pohlaví podařilo dosáhnout výšky nad 130 cm, 92 (52,5 %) nad 140 cm a 32 (18,3 %) 150–160 cm a více. Současně 37 pacientů (21,2 %) zvětšilo svou výšku o 30 cm, 107 (61,1 %) o 31–50 cm a 31 (17,7 %) o 51–60 cm a více.
Předpověď
Prognóza závisí na formě nanismu. U genetických typů nanismu je prognóza pro život příznivá. V přítomnosti nádoru hypofýzy a organického poškození centrálního nervového systému je určena dynamikou vývoje hlavního patologického procesu. Moderní metody terapie významně zvýšily fyzické schopnosti a pracovní kapacitu pacientů a prodloužily jejich délku života. Během období aktivní léčby je nutné pacienty vyšetřovat lékařem každé 2–3 měsíce, při udržovací terapii – každých 6–12 měsíců.
Zaměstnání pacientů, které odpovídá jejich intelektuálním a fyzickým schopnostem, má pro jejich sociální adaptaci zásadní význam.
Je vhodné volit profese, které nejsou spojeny s těžkou fyzickou námahou, ale umožňují prokázat intelektuální schopnosti, schopnost vykonávat přesnou práci a jazyky.


 [
[