Lékařský expert článku
Nové publikace
Jehlová elektromyografie
Naposledy posuzováno: 06.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Jehlová elektromyografie zahrnuje následující hlavní metody:
- standardní jehlový EMG;
- EMG jednoho svalového vlákna;
- makroEMG;
- skenovací EMG.
Standardní jehlová elektromyografie
Jehlová elektromyografie je invazivní vyšetřovací metoda prováděná pomocí koncentrické jehlové elektrody zavedené do svalu. Jehlová elektromyografie umožňuje vyhodnotit periferní neuromotorický aparát: morfofunkční organizaci motorických jednotek kosterního svalstva, stav svalových vláken (jejich spontánní aktivitu) a v případě dynamického pozorování - vyhodnotit účinnost léčby, dynamiku patologického procesu a prognózu onemocnění.
Diagnostická hodnota
Standardní jehlová elektromyografie zaujímá ústřední místo mezi elektrofyziologickými výzkumnými metodami u různých neuromuskulárních onemocnění a má rozhodující význam v diferenciální diagnostice neurogenních a primárních svalových onemocnění.
Tato metoda se používá k určení závažnosti denervace ve svalu inervovaném postiženým nervem, stupně jeho zotavení a účinnosti reinervace.
Jehlová elektromyografie našla své uplatnění nejen v neurologii, ale také v revmatologii, endokrinologii, sportovním a pracovním lékařství, pediatrii, urologii, gynekologii, chirurgii a neurochirurgii, oftalmologii, stomatologii a maxilofaciální chirurgii, ortopedii a řadě dalších lékařských oborů.
Indikace postupu
Onemocnění motorických neuronů míchy ( ALS, spinální amyotrofie, poliomyelitida a post-polio syndrom, syringomyelie atd.), myelopatie, radikulopatie, různé neuropatie (axonální a demyelinizační), myopatie, zánětlivá svalová onemocnění ( polymyozitida a dermatomyozitida ), centrální poruchy hybnosti, poruchy sfinkterů a řada dalších situací, kdy je nutné objektivizovat stav motorických funkcí a systému řízení pohybu, posoudit zapojení různých struktur periferního neuromotorického aparátu do procesu.
 [ 6 ]
[ 6 ]
Příprava
Pacient nepotřebuje k vyšetření žádnou speciální přípravu. Jehlová elektromyografie vyžaduje úplné uvolnění vyšetřovaných svalů, proto se provádí v poloze pacienta vleže. Pacient je vystaven vyšetřovaným svalům, uložen na záda (nebo na břicho) na pohodlné měkké lehátko s nastavitelnou opěrkou hlavy, informován o nadcházejícím vyšetření a vysvětlen mu je, jak má sval napínat a poté uvolňovat.
 [ 7 ]
[ 7 ]
Technika jehlová elektromyografie
Studie se provádí pomocí koncentrické jehlové elektrody zavedené do motorického bodu svalu (přípustný poloměr není větší než 1 cm pro velké svaly a 0,5 cm pro malé). Zaznamenávají se potenciály MU (PMU). Při výběru PMU pro analýzu je nutné dodržovat určitá pravidla pro jejich výběr.
Opakovaně použitelné jehlové elektrody se předsterilizují v autoklávu nebo jinými sterilizačními metodami. Jednorázové sterilní jehlové elektrody se otevírají bezprostředně před vyšetřením svalu.
Po zavedení elektrody do zcela uvolněného svalu a při každém jejím pohybu se sleduje možný výskyt spontánní aktivity. PMU se zaznamenává s minimálním volním svalovým napětím, což umožňuje identifikaci jednotlivých PMU. Vybere se 20 různých PMU, přičemž se sleduje určitá sekvence pohybu elektrody ve svalu.
Při hodnocení stavu svalů se provádí kvantitativní analýza zjištěné spontánní aktivity, což je obzvláště důležité při sledování stavu pacienta v čase, stejně jako při stanovení účinnosti terapie. Analyzují se parametry zaznamenaných potenciálů různých motorických jednotek.
Jehlová elektromyografie u synaptických onemocnění
U synaptických onemocnění je jehlová elektromyografie považována za doplňkovou vyšetřovací metodu. U myastenie umožňuje posoudit stupeň „blokování“ svalových vláken v MU, určený stupněm snížení průměrné doby trvání MU ve vyšetřovaných svalech. Hlavním cílem jehlové elektromyografie u myastenie je však vyloučení možné souběžné patologie (polymyozitida, myopatie, endokrinní poruchy, různé polyneuropatie atd.). Jehlová elektromyografie se u pacientů s myastenieí používá také k určení stupně reakce na podání anticholinesterázových léků, tj. k posouzení změny parametrů MU při podání neostigmin-methylsulfátu (proserinu). Po podání léku se doba trvání MU ve většině případů prodlužuje. Absence reakce může naznačovat tzv. myastenickou myopatii.
Hlavní elektromyografická kritéria synaptických onemocnění:
- zkrácení průměrné doby trvání PDE;
- pokles amplitudy jednotlivých PMU (může chybět);
- mírná polyfázie PDE (může chybět);
- absence spontánní aktivity nebo přítomnost pouze izolovaného PF.
U myasthenie je průměrná doba trvání MUAP obvykle mírně zkrácena (o 10–35 %). Většina MUAP má normální amplitudu, ale v každém svalu je zaznamenáno několik MUAP se sníženou amplitudou a trváním. Počet polyfázických MUAP nepřesahuje 15–20 %. Spontánní aktivita chybí. Pokud je u pacienta zjištěna výrazná PF, je třeba zvážit kombinaci myasthenie s hypotyreózou, polymyozitidou nebo jinými onemocněními.
Jehlová elektromyografie u primárních svalových onemocnění
Jehlová elektromyografie je hlavní elektrofyziologickou metodou pro diagnostiku primárních svalových onemocnění (různých myopatií). Vzhledem ke snížené schopnosti motorických jednotek vyvinout dostatečnou sílu k udržení i minimálního úsilí musí pacient s jakoukoli primární svalovou patologií aktivovat velké množství motorických jednotek. To určuje zvláštnost elektromyografie u těchto pacientů. Při minimálním volním svalovém napětí je obtížné izolovat jednotlivé motorické jednotky; na obrazovce se objevuje takové množství malých potenciálů, že je jejich identifikace nemožná. Jedná se o tzv. myopatický vzorec elektromyografie.
U zánětlivých myopatií (polymyozitida) dochází k procesu reinervace, který může způsobit zvýšení parametrů MUAP.
Hlavní elektromyografická kritéria primárních svalových onemocnění:
- zkrácení průměrné doby trvání PDE o více než 12 %;
- pokles amplitudy jednotlivých PMU (průměrná amplituda může být buď snížená, nebo normální, a někdy i zvýšená);
- polyfázie PDE;
- výrazná spontánní aktivita svalových vláken u zánětlivé myopatie (polymyozitidy) nebo PMD (v ostatních případech je minimální nebo chybí).
Snížení průměrné doby trvání MUAP je kardinálním příznakem jakéhokoli primárního svalového onemocnění. Důvodem této změny je, že u myopatií dochází k atrofii svalových vláken, některá z nich v důsledku nekrózy vypadávají ze složení MU, což vede ke snížení parametrů MUAP. Snížení doby trvání většiny MUAP je detekováno téměř ve všech svalech pacientů s myopatiemi, i když je výraznější v klinicky nejvíce postižených proximálních svalech.
Histogram rozdělení PMU podle trvání se posouvá směrem k menším hodnotám (stádium I nebo II). Výjimkou je PMD: v důsledku ostré polyfázie PMU, někdy dosahující 100 %, se může průměrná délka trvání výrazně prodloužit.
Elektromyografie jednotlivých svalových vláken
Elektromyografie jednotlivých svalových vláken umožňuje studium elektrické aktivity jednotlivých svalových vláken, včetně stanovení jejich hustoty ve svalových motorických jednotkách a spolehlivosti neuromuskulárního přenosu pomocí metody jitteru.
Pro provedení studie je zapotřebí speciální elektroda s velmi malou výbojovou plochou o průměru 25 µm, umístěná na jejím bočním povrchu 3 mm od konce. Malá výbojová plocha umožňuje zaznamenávat potenciály jednoho svalového vlákna v zóně o poloměru 300 µm.
Studie hustoty svalových vláken
Stanovení hustoty svalových vláken v MU je založeno na skutečnosti, že zóna mikroelektrody pro záznam aktivity jednoho svalového vlákna je striktně definovaná. Mírou hustoty svalových vláken v MU je průměrný počet potenciálů jednotlivých svalových vláken zaznamenaných v zóně jejich záznamu během studia 20 různých MU v různých zónách svalu. Normálně může tato zóna obsahovat pouze jedno (vzácně dvě) svalová vlákna patřící do stejné MU. Pomocí speciální metodické techniky (spouštěcího zařízení) je možné zabránit zobrazení potenciálů jednotlivých svalových vláken patřících do jiných MU na obrazovce.
Průměrná hustota vláken se měří v konvenčních jednotkách výpočtem průměrného počtu potenciálů jednotlivých svalových vláken patřících k různým MU. U zdravých lidí se tato hodnota pohybuje v závislosti na svalu a věku od 1,2 do 1,8. Zvýšení hustoty svalových vláken v MU odráží změnu struktury MU ve svalu.
Výzkum fenoménu jitteru
Normálně je vždy možné umístit elektrodu pro záznam jednoho svalového vlákna ve svalu tak, aby byly zaznamenány potenciály dvou sousedních svalových vláken patřících do jedné motorické jednotky. Pokud je potenciál prvního vlákna aktivován spouštěcím zařízením, potenciál druhého vlákna se bude časově mírně lišit, protože impuls potřebuje různou dobu k průchodu dvěma nervovými zakončeními různých délek. To se odráží ve variabilitě mezivrcholového intervalu, tj. doba záznamu druhého potenciálu kolísá ve vztahu k prvnímu, definovanému jako potenciálový „tanec“ nebo „jitter“, jehož hodnota je obvykle 5–50 μs.
Jitter odráží variabilitu času neuromuskulárního přenosu ve dvou motorických koncových ploténkách, takže tato metoda nám umožňuje studovat stabilitu neuromuskulárního přenosu. Pokud je narušen jakoukoli patologií, jitter se zvyšuje. Jeho nejvýraznější zvýšení je pozorováno u synaptických onemocnění, především u myastenie.
Při výrazném zhoršení neuromuskulárního přenosu nastává stav, kdy nervový impuls nemůže vybudit jedno ze dvou sousedních vláken a dochází k tzv. blokádě impulsu.
U ALS je také pozorován významný nárůst jitteru a nestability jednotlivých složek PMU. To se vysvětluje skutečností, že terminály a nezralé synapse nově vytvořené v důsledku sproutingu fungují s nedostatečnou mírou spolehlivosti. V tomto případě je nejvýraznější jitter a blokování impulzů pozorováno u pacientů s rychlou progresí procesu.
Makroelektromyografie
Makroelektromyografie nám umožňuje posoudit velikost motorických jednotek v kosterních svalech. Během studie se současně používají dvě jehlové elektrody: speciální makroelektroda zavedená hluboko do svalu tak, aby abduktorová laterální plocha elektrody byla v tloušťce svalu, a běžná koncentrická elektroda zavedená pod kůži. Metoda makroelektromyografie je založena na studiu potenciálu zaznamenaného makroelektrodou s velkou abduktorovou plochou.
Jako referenční elektroda slouží konvenční koncentrická elektroda, která se zavádí pod kůži ve vzdálenosti nejméně 30 cm od hlavní makroelektrody do zóny minimální aktivity studovaného svalu, tj. co nejdále od motorického bodu svalu.
Další elektroda pro záznam potenciálů jednotlivých svalových vláken, umístěná v kanyle, registruje potenciál svalového vlákna studované MU, což slouží jako spouštěč pro průměrování makropotenciálu. Signál z kanyly hlavní elektrody také vstupuje do průměrovače. Průměruje se 130–200 pulzů (epocha 80 ms, pro analýzu se používá perioda 60 ms), dokud se neobjeví stabilní izoliniální linie a stabilní amplitudový makropotenciál MU. Registrace se provádí na dvou kanálech: na jednom se zaznamenává signál z jednoho svalového vlákna studované MU, což spouští průměrování, na druhém se reprodukuje signál mezi hlavní a referenční elektrodou.
Hlavním parametrem používaným k hodnocení makropotenciálu motorické jednotky je jeho amplituda, měřená od vrcholu k vrcholu. Doba trvání potenciálu není při použití této metody důležitá. Je možné vyhodnotit plochu makropotenciálů motorické jednotky. Normálně existuje široké rozmezí hodnot jeho amplitudy, s věkem se poněkud zvyšuje. U neurogenních onemocnění se amplituda makropotenciálů motorické jednotky zvyšuje v závislosti na stupni reinervace ve svalu. U neuronálních onemocnění je nejvyšší.
V pozdních stádiích onemocnění se amplituda makropotenciálů MU snižuje, zejména s významným poklesem svalové síly, což se shoduje se snížením parametrů MU zaznamenaných standardní jehlovou elektromyografií.
U myopatií je zaznamenán pokles amplitudy makropotenciálů motorických jednotek, u některých pacientů jsou však jejich průměrné hodnoty normální, přesto je stále zaznamenán určitý počet potenciálů se sníženou amplitudou. Žádná ze studií, které zkoumaly svaly pacientů s myopatií, neodhalila zvýšení průměrné amplitudy makropotenciálů motorických jednotek.
Metoda makroelektromyografie je velmi pracná, proto se v běžné praxi široce nepoužívala.
Skenovací elektromyografie
Metoda umožňuje studium časového a prostorového rozložení elektrické aktivity motorické jednotky skenováním, tj. krokovým pohybem elektrody v oblasti umístění vláken studované motorické jednotky. Skenovací elektromyografie poskytuje informace o prostorovém umístění svalových vláken v celém prostoru motorické jednotky a může nepřímo indikovat přítomnost svalových skupin, které vznikají v důsledku procesu denervace svalových vláken a jejich opakované reinervace.
Při minimálním volním napětí svalu se jako spouštěč používá elektroda zavedená do něj pro záznam jednoho svalového vlákna a pomocí výstupní koncentrické jehlové (skenovací) elektrody se zaznamenává PMU ze všech stran v průměru 50 mm. Metoda je založena na pomalém postupném ponořování standardní jehlové elektrody do svalu, akumulaci informací o změně parametrů potenciálu určité MU a konstrukci odpovídajícího obrazu na obrazovce monitoru. Skenovací elektromyografie je série oscilogramů umístěných pod sebou, z nichž každý odráží oscilace biopotenciálu zaznamenaného v daném bodě a zachyceného výstupní plochou koncentrické jehlové elektrody.
Následná počítačová analýza všech těchto MUAP a analýza jejich trojrozměrného rozložení poskytuje vhled do elektrofyziologického profilu motorických neuronů.
Při analýze dat skenovací elektromyografie se hodnotí počet hlavních vrcholů MUAP, jejich posun v čase výskytu, délka intervalů mezi výskytem jednotlivých zlomků potenciálu dané MU a vypočítá se průměr zóny distribuce vláken v každé ze zkoumaných MU.
U DRP se amplituda a trvání, stejně jako plocha potenciálních oscilací na skenovací elektromyografii, zvyšuje. Průřez zóny distribuce vláken jednotlivých DE se však významně nemění. Nemění se ani počet frakcí charakteristických pro daný sval.
Kontraindikace k postupu
Pro jehlovou elektromyografii prakticky neexistují žádné kontraindikace. Za omezení se považuje stav bezvědomí pacienta, kdy nemůže sval dobrovolně napnout. I v tomto případě je však možné určit přítomnost nebo nepřítomnost aktuálního procesu ve svalech (přítomností nebo nepřítomností spontánní aktivity svalových vláken). Jehlovou elektromyografii je třeba provádět s opatrností u svalů s výraznými hnisavými ranami, nehojícími se vředy a hlubokými popáleninovými lézemi.
Normální výkon
DE je strukturální a funkční prvek kosterního svalu. Je tvořen motorickým neuronem umístěným v předním rohu šedé hmoty míchy, jehož axon vychází jako myelinizované nervové vlákno jako součást motorického kořene, a skupinou svalových vláken, která vytvářejí kontakt s četnými větvemi tohoto axonu, zbavenými myelinové pochvy - zakončeními, pomocí synapse.
Každé svalové vlákno svalu má svůj vlastní terminál, je součástí pouze jedné motorické jednotky a má svou vlastní synapsi. Axony se začínají intenzivně větvit na úrovni několika centimetrů před svalem, aby zajistily inervaci každého svalového vlákna, které je součástí této motorické jednotky. Motorický neuron generuje nervový impuls, který se přenáší podél axonu, je zesílen v synapsi a způsobuje kontrakci všech svalových vláken patřících k této motorické jednotce. Celkový bioelektrický potenciál zaznamenaný během takové kontrakce svalových vláken se nazývá potenciál motorické jednotky.
Potenciály motorických jednotek
Hodnocení stavu motorických jednotek lidského kosterního svalstva se provádí na základě analýzy parametrů potenciálů, které generují: trvání, amplituda a tvar. Každá motorická jednotka vzniká algebraickým součtem potenciálů všech svalových vláken, které tvoří motorickou jednotku, jež funguje jako jeden celek.
Když se excitační vlna šíří podél svalových vláken směrem k elektrodě, na obrazovce monitoru se objeví třífázový potenciál: první odchylka je kladná, poté následuje rychlý záporný vrchol a potenciál končí třetí, opět kladnou odchylkou. Tyto fáze mohou mít různé amplitudy, trvání a plochy, které závisí na tom, jak je výstupní plocha elektrody umístěna vzhledem k centrální části zaznamenané DE.
Parametry PMU odrážejí velikost DE, množství, vzájemné uspořádání svalových vláken a hustotu jejich rozložení v každé konkrétní DE.
Normální doba trvání potenciálu motorické jednotky
Hlavním parametrem parciální diferenciální rovnice (PDR) je její trvání, neboli délka, měřená jako čas v milisekundách od začátku odchylky signálu od středové čáry až do jeho úplného návratu k ní.
Délka PMU u zdravého člověka závisí na svalu a věku. S věkem se délka PMU prodlužuje. Za účelem vytvoření jednotných kritérií pro normu při studiu PMU byly vyvinuty speciální tabulky normálních průměrných hodnot trvání pro různé svaly lidí různého věku. Fragment těchto tabulek je uveden níže.
Mírou posouzení stavu MU ve svalu je průměrná délka 20 různých MUAP zaznamenaných v různých bodech studovaného svalu. Průměrná hodnota získaná během studie se porovná s odpovídajícím ukazatelem uvedeným v tabulce a vypočítá se odchylka od normy (v procentech). Průměrná délka MUAP se považuje za normální, pokud se pohybuje v rozmezí ±12 % hodnoty uvedené v tabulce (v zahraničí se průměrná délka MUAP považuje za normální, pokud se pohybuje v rozmezí ±20 %).
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Trvání potenciálů motorických jednotek v patologii
Hlavním vzorcem změn v trvání PDE za patologických stavů je, že se prodlužuje u neurogenních onemocnění a snižuje u synaptické a primární svalové patologii.
Pro důkladnější posouzení stupně změny PMU ve svalech s různými lézemi periferního neuromotorického aparátu se pro každý sval používá histogram distribuce PMU podle trvání, protože jejich průměrná hodnota se může při zjevné svalové patologii pohybovat v mezích normálních odchylek. Histogram má obvykle tvar normálního rozdělení, jehož maximum se shoduje s průměrnou dobou trvání PMU pro daný sval. Při jakékoli patologii periferního neuromotorického aparátu se tvar histogramu významně mění.
Elektromyografické fáze patologického procesu
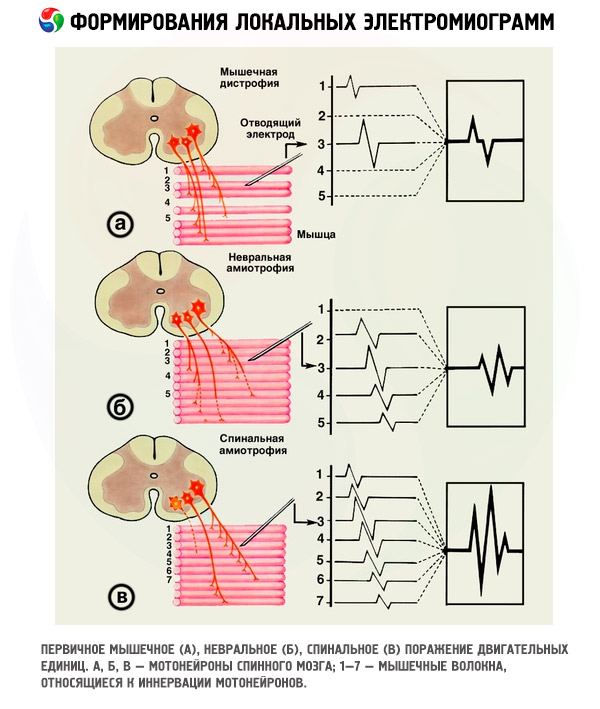
Na základě změny v trvání MU u onemocnění motorických neuronů míchy, kdy lze všechny změny probíhající ve svalech vysledovat v relativně krátkém časovém období, bylo identifikováno šest EMG stádií, které odrážejí obecné vzorce restrukturalizace MU během procesu denervace-reinnervace (DRP), od samého začátku onemocnění až po téměř úplnou smrt svalu.
Všechna neurogenní onemocnění jsou charakterizována odumíráním většího či menšího počtu motorických neuronů nebo jejich axonů. Přeživší motorické neurony inervují „cizí“ svalová vlákna zbavená nervové kontroly, čímž se zvyšuje jejich počet v jejich motorických neuronech (MU). Na elektromyografii se tento proces projevuje postupným zvyšováním parametrů potenciálů takových MU. Celý cyklus změn v histogramu distribuce MU podle trvání u neuronálních onemocnění je konvenčně rozdělen do pěti EMG stádií, které odrážejí proces kompenzační inervace ve svalech. Ačkoli je takové rozdělení konvenční, pomáhá pochopit a sledovat všechny fáze vývoje DRP v každém konkrétním svalu, protože každá fáze odráží určitou fázi reinervace a stupeň její závažnosti. Není vhodné prezentovat fázi VI jako histogram, protože odráží konečný bod „reverzního“ procesu, tj. proces dekompenzace a destrukce svalové MU.
Mezi specialisty v naší zemi se tato stádia rozšířila v diagnostice různých neuromuskulárních onemocnění. Jsou zahrnuta v počítačovém programu domácích elektromyografů, který umožňuje automatickou konstrukci histogramů označujících stádium procesu. Změna stádia v jednom či druhém směru při opakovaném vyšetření pacienta ukazuje, jaké jsou další vyhlídky na rozvoj DRP.
- Stádium I: průměrná doba trvání MUAP je zkrácena o 13-20 %. Tato fáze odráží samotnou počáteční fázi onemocnění, kdy denervace již začala a proces reinervace se elektromyograficky ještě neprojevuje. Ze složení některých MU vypadnou některá denervovaná svalová vlákna, zbavená impulzního vlivu v důsledku patologie buď motorického neuronu, nebo jeho axonu. Počet svalových vláken v takových MUAP se snižuje, což vede ke zkrácení doby trvání jednotlivých potenciálů. Ve stádiu I se objevuje určitý počet užších potenciálů než ve zdravém svalu, což způsobuje mírné snížení průměrné doby trvání. Histogram rozdělení MUAP se začíná posouvat doleva, směrem k menším hodnotám.
- Fáze II: průměrná doba trvání MUAP je zkrácena o 21 % nebo více. U DRP je tato fáze pozorována extrémně zřídka a pouze v případech, kdy z nějakého důvodu nedochází k reinervaci nebo je potlačena nějakým faktorem (např. alkoholem, zářením atd.), zatímco denervace se naopak zvyšuje a dochází k masivnímu odumírání svalových vláken v MUAP. To vede k tomu, že většina nebo téměř všechny MUAP se zkracují oproti normálu, v důsledku čehož se průměrná doba trvání dále snižuje. Histogram distribuce MUAP se výrazně posouvá směrem k menším hodnotám. Fáze I-II odrážejí změny v MUAP způsobené poklesem počtu funkčních svalových vláken v nich.
- Stádium III: průměrná délka MUAP se pohybuje v rozmezí ±20 % od normy pro daný sval. Tato fáze je charakterizována výskytem určitého počtu potenciálů se zvýšenou délkou trvání, normálně nedetekovatelných. Výskyt těchto MUAP naznačuje nástup reinervace, tj. denervovaná svalová vlákna začínají být zahrnuta do dalších MUAP, v důsledku čehož se parametry jejich potenciálů zvyšují. Ve svalu jsou současně zaznamenávány MUAP jak snížené, tak normální, a také zvýšené délky trvání, počet zvětšených MUAP ve svalu se pohybuje od jednoho do několika. Průměrná délka MUAP ve stádiu III může být normální, ale vzhled histogramu se liší od normy. Nemá tvar normálního rozdělení, ale je „zploštělý“, natažený a začíná se posouvat doprava, směrem k větším hodnotám. Navrhuje se rozdělit stádium III do dvou podskupin - IIIA a IIIB. Liší se pouze tím, že ve stádiu IIIA je průměrná doba trvání MUAP zkrácena o 1-20 % a ve stádiu IIIB se buď zcela shoduje s průměrnou hodnotou normy, nebo se zvýší o 1-20 %. Ve stádiu IIIB je zaznamenán o něco větší počet MUAP se zvýšenou délkou trvání než ve stádiu IIIA. Praxe ukázala, že takové rozdělení třetího stádia do dvou podskupin nemá velký význam. Ve skutečnosti stádium III jednoduše znamená výskyt prvních EMG známek reinervace ve svalu.
- Fáze IV: průměrná doba trvání MUAP se zvyšuje o 21-40 %. Tato fáze je charakterizována zvýšením průměrné doby trvání MUAP v důsledku výskytu velkého počtu potenciálů se zvýšenou délkou trvání, spolu s normálními MUAP. MUAP se zkrácenou délkou trvání jsou v této fázi zaznamenávány extrémně zřídka. Histogram je posunut doprava, směrem k větším hodnotám, jeho tvar je odlišný a závisí na poměru MUAP normální a zvýšené délky trvání.
- Fáze V: průměrná doba trvání MUAP je zvýšena o 41 % nebo více. Tato fáze je charakterizována přítomností převážně velkých a „obřích“ MUAP, zatímco MUAP normální doby trvání prakticky chybí. Histogram je výrazně posunutý doprava, natažený a zpravidla otevřený. Tato fáze odráží maximální objem reinervace ve svalu a také její účinnost: čím více obřích MUAP, tím účinnější je reinervace.
- Fáze VI: průměrná doba trvání MUAP je v normálních mezích nebo je zkrácena o více než 12 %. Tato fáze je charakterizována přítomností MUAP (potenciálů zhoršujících se MU), které mají změněný tvar. Jejich parametry mohou být formálně normální nebo snížené, ale tvar MUAP je změněn: potenciály nemají ostré vrcholy, jsou natažené, zaoblené, doba náběhu potenciálu je prudce zvýšena. Tato fáze je pozorována v poslední fázi dekompenzace DRP, kdy většina motorických neuronů míchy již odumřela a zbytek intenzivně odumírá. Dekompenzace procesu začíná od okamžiku, kdy se proces denervace zvyšuje a zdroje inervace se stávají stále menšími. Na EMG je fáze dekompenzace charakterizována následujícími znaky: parametry MUAP začínají klesat, obří MUAP postupně mizí, intenzita PF prudce roste, objevují se obří POW, což naznačuje odumření mnoha sousedních svalových vláken. Tyto příznaky naznačují, že v tomto svalu motorické neurony v důsledku funkční nedostatečnosti vyčerpaly své pučící schopnosti a již nejsou schopny plně ovládat svá vlákna. V důsledku toho se počet svalových vláken v motorické jednotce postupně snižuje, mechanismy vedení impulsů jsou narušeny, potenciály těchto motorických jednotek se zaoblují, jejich amplituda se snižuje a zkracuje se jejich trvání. Vykreslování histogramu v této fázi procesu je nevhodné, protože stejně jako průměrná doba trvání PMU již neodráží skutečný stav svalu. Hlavním příznakem stadia VI je změna tvaru všech PMU.
EMG stádia se používají nejen u neurogenních onemocnění, ale také u různých primárních svalových onemocnění k charakterizaci hloubky svalové patologie. V tomto případě EMG stádium neodráží DRP, ale závažnost patologie a nazývá se „EMG stádium patologického procesu“. U primárních svalových dystrofií se mohou objevit ostře polyfázické PMU se satelity, které prodlužují jejich trvání, což významně zvyšuje jejich průměrnou hodnotu, odpovídající III. nebo dokonce IV. EMG stádiu patologického procesu.
Diagnostický význam EMG fází
- U neuronálních onemocnění jsou u stejného pacienta často detekovány různé EMG fáze v různých svalech - fáze III až VI jsou detekovány velmi zřídka - na samém začátku onemocnění a pouze v jednotlivých svalech.
- U axonálních a demyelinizačních onemocnění se nejčastěji detekují stadia III a IV, méně častá jsou stadia I a II. Stadium V se detekuje, když v jednotlivých, nejvíce postižených svalech odumírá významný počet axonů.
- U primárních svalových onemocnění dochází ke ztrátě svalových vláken ze složení MU v důsledku nějaké svalové patologie: snížení průměru svalových vláken, jejich štěpení, fragmentace nebo jiné poškození, které snižuje počet svalových vláken v MU nebo snižuje objem svalu. To vše vede ke snížení (zkrácení) trvání PMU. Proto se u většiny primárních svalových onemocnění a myastenie detekují stadia I a II, u polymyositidy - zpočátku pouze I a I a po zotavení - III a dokonce IV stadium.
Amplituda potenciálu motorické jednotky
Amplituda je pomocný, ale velmi důležitý parametr při analýze MUAP. Měří se „od vrcholu k vrcholu“, tj. od nejnižšího bodu kladného vrcholu k nejvyššímu bodu záporného vrcholu. Při registraci MUAP na obrazovce se jejich amplituda určuje automaticky. Určuje se jak průměrná, tak maximální amplituda MUAP detekovaného ve studovaném svalu.
Průměrné hodnoty amplitudy MUAP v proximálních svalech zdravých lidí jsou ve většině případů 500-600 μV, v distálních svalech 600-800 μV, přičemž maximální amplituda nepřesahuje 1500-1700 μV. Tyto ukazatele jsou velmi podmíněné a mohou se do určité míry lišit. U dětí ve věku 8-12 let je průměrná amplituda MUAP zpravidla v rozmezí 300-400 μV a maximální nepřesahuje 800 μV; u starších dětí jsou tyto ukazatele 500 a 1000 μV. V obličejových svalech je amplituda MUAP výrazně nižší.
U sportovců je v trénovaných svalech zaznamenána zvýšená amplituda MUAP. Zvýšení průměrné amplitudy MUAP ve svalech zdravých sportovců proto nelze považovat za patologii, protože k němu dochází v důsledku restrukturalizace MU v důsledku dlouhodobé zátěže svalů.
U všech neurogenních onemocnění se amplituda PMU zpravidla zvyšuje v souladu se zvyšující se dobou trvání: čím delší je doba trvání potenciálu, tím vyšší je jeho amplituda.
Nejvýznamnější zvýšení amplitudy MUAP je pozorováno u neuronálních onemocnění, jako je spinální amyotrofie a následky poliomyelitidy. Slouží jako další kritérium pro diagnostiku neurogenní povahy patologie ve svalech. Zvýšení amplitudy MUAP je způsobeno reorganizací MU ve svalu, zvýšením počtu svalových vláken v zóně přívodu elektrody, synchronizací jejich aktivity a zvětšením průměru svalových vláken.
Zvýšení průměrné i maximální amplitudy MUAP je někdy pozorováno u některých primárních svalových onemocnění, jako je polymyozitida, primární svalová dystrofie, dystrofická myotonie atd.
Křivka potenciálu motorické jednotky
Tvar parciálního potenciálu (PDE) závisí na struktuře DE, stupni synchronizace potenciálů jejích svalových vláken, poloze elektrody vzhledem ke svalovým vláknům analyzované DE a jejich inervačních zónách. Tvar potenciálu nemá diagnostickou hodnotu.
V klinické praxi se tvar MUAP analyzuje z hlediska počtu fází a/nebo závitů v potenciálu. Každá odchylka kladného a záporného potenciálu, která dosáhne izolinii a protne ji, se nazývá fáze a odchylka kladného a záporného potenciálu, která izolinii nedosáhne, se nazývá závit.
Potenciál se považuje za polyfázový, pokud má pět nebo více fází a protíná axiální čáru alespoň čtyřikrát. Potenciál může mít další závity, které neprotínají axiální čáru. Závity se mohou nacházet v záporné i kladné části potenciálu.
Ve svalech zdravých lidí jsou MUAP obvykle reprezentovány třífázovými potenciálními oscilacemi, avšak při záznamu MUAP v zóně koncové ploténky může mít dvě fáze a ztrácet tak svou počáteční kladnou část.
Normálně počet polyfázických MUAP nepřesahuje 5-15 %. Zvýšení počtu polyfázických MUAP je považováno za známku poruchy struktury MU v důsledku přítomnosti nějakého patologického procesu. Polyfázické a pseudopolyfázické MUAP jsou zaznamenávány jak u neuronálních, tak u axonálních onemocnění, a také u primárních svalových onemocnění.
 [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Spontánní aktivita
Za normálních podmínek, když je elektroda v uvolněném svalu zdravého člověka v klidu, nedochází k žádné elektrické aktivitě. V patologii se objevuje spontánní aktivita svalových vláken neboli DE. Spontánní aktivita nezávisí na vůli pacienta, nemůže ji zastavit ani libovolně vyvolat.
Spontánní aktivita svalových vláken
Spontánní aktivita svalových vláken zahrnuje fibrilační potenciály (FP) a pozitivní ostré vlny (PSW). FP a PSB se zaznamenávají výhradně za patologických podmínek, když je do svalu zavedena koncentrická jehlová elektroda. FP je potenciál jednoho svalového vlákna, PSB je pomalá oscilace, která vzniká po rychlé pozitivní výchylce, bez ostrého negativního vrcholu. PSB odráží účast jednoho i několika sousedních vláken.
Studium spontánní aktivity svalových vláken v podmínkách klinického vyšetření pacienta je nejpohodlnější elektrofyziologickou metodou, která umožňuje posoudit stupeň úplnosti a stability nervových vlivů na svalová vlákna kosterního svalu v jeho patologii.
Spontánní aktivita svalových vláken se může vyskytnout u jakékoli patologie periferního neuromotorického aparátu. U neurogenních onemocnění, stejně jako u synapsí (myastenie a myastenické syndromy), spontánní aktivita svalových vláken odráží proces jejich denervace. U většiny primárních svalových onemocnění spontánní aktivita svalových vláken odráží určité poškození svalových vláken (jejich štěpení, fragmentace atd.), stejně jako jejich patologii způsobenou zánětlivým procesem (u zánětlivých myopatií - polymyozitida, dermatomyozitida). V obou případech PF a POV naznačují přítomnost probíhajícího procesu ve svalu; normálně se nikdy nezaznamenávají.
- Trvání PF je 1–5 ms (nemá diagnostickou hodnotu) a amplituda kolísá ve velmi širokých mezích (v průměru 118 ± 114 μV). Někdy jsou také detekovány PF s vysokou amplitudou (až 2000 μV), obvykle u pacientů s chronickými onemocněními. Načasování výskytu PF závisí na lokalizaci nervové léze. Ve většině případů se vyskytují 7–20 dní po denervaci.
- Pokud z nějakého důvodu nedojde k reinervaci denervovaného svalového vlákna, časem odumírá a generuje POW, které jsou EMG považovány za známku úmrtí denervovaného svalového vlákna, které nedostalo inervaci, kterou dříve ztratilo. Počet PF a POW zaznamenaných v každém svalu lze nepřímo použít k posouzení stupně a hloubky jeho denervace nebo objemu odumřelých svalových vláken. Trvání POW je od 1,5 do 70 ms (ve většině případů až 10 ms). Takzvané obří POW trvající více než 20 ms jsou detekovány při prodloužené denervaci velkého počtu sousedních svalových vláken, stejně jako při polymyozitidě. Amplituda POW obvykle kolísá mezi 10 a 1800 μV. POW s velkou amplitudou a trváním jsou častěji detekovány v pozdějších stádiích denervace („obří“ POW). POV jsou poprvé zaznamenány 16–30 dní po prvním výskytu PF; Mohou přetrvávat ve svalu několik let po denervaci. U pacientů se zánětlivými lézemi periferních nervů jsou POV zpravidla detekovány později než u pacientů s traumatickými lézemi.
PF a POV reagují na zahájení terapie nejrychleji: pokud je účinná, závažnost PF a POV se po 2 týdnech snižuje. Naopak, pokud je léčba neúčinná nebo nedostatečně účinná, jejich závažnost se zvyšuje, což umožňuje použít analýzu PF a POV jako indikátor účinnosti používaných léků.
Myotonické a pseudomyotonické výboje
Myotonické a pseudomyotonické výboje, neboli vysokofrekvenční výboje, označují také spontánní aktivitu svalových vláken. Myotonické a pseudomyotonické výboje se liší řadou znaků, z nichž hlavní je vysoká opakovatelnost prvků, které výboj tvoří, tj. vysoká frekvence potenciálů ve výboji. Pojem „pseudomyotonický výboj“ je stále častěji nahrazován pojmem „vysokofrekvenční výboj“.
- Myotonické výboje jsou jev detekovatelný u pacientů s různými formami myotonie. Při poslechu připomínají zvuk „střemhlavého bombardéru“. Na obrazovce monitoru vypadají tyto výboje jako opakující se potenciály s postupně klesající amplitudou a progresivně se prodlužujícími intervaly (což způsobuje pokles výšky tónu). Myotonické výboje jsou někdy pozorovány u některých forem endokrinní patologie (například hypotyreóza). Myotonické výboje vznikají buď spontánně, nebo po mírné kontrakci či mechanickém podráždění svalu zavedenou jehlovou elektrodou nebo pouhým poklepáním na sval.
- Pseudomyotonické výboje (vysokofrekvenční výboje) jsou zaznamenávány u některých neuromuskulárních onemocnění, a to jak spojených, tak i nesouvisejících s denervací svalových vláken. Jsou považovány za důsledek efaptické transmise excitace se snížením izolačních vlastností membrány svalových vláken, což vytváří předpoklad pro šíření excitace z jednoho vlákna na sousední: pacemaker jednoho z vláken udává rytmus impulsů, který je vnucován sousedním vláknům, což způsobuje jedinečný tvar komplexů. Výboje začínají a končí náhle. Jejich hlavním rozdílem od myotonických výbojů je absence poklesu amplitudy složek. Pseudomyotonické výboje jsou pozorovány u různých forem myopatie, polymyozitidy, denervačních syndromů (v pozdních stádiích reinervace), spinálních a nervových amyotrofií (Charcot-Marie-Toothova choroba), endokrinní patologie, poranění nebo komprese nervu a některých dalších onemocnění.
Spontánní aktivita motorických jednotek
Spontánní aktivitu motorické jednotky reprezentují fascikulační potenciály. Fascikulace jsou spontánní kontrakce celé motorické jednotky, ke kterým dochází v naprosto uvolněném svalu. Jejich výskyt je spojen s onemocněním motorického neuronu, jeho přetížením svalovými vlákny, podrážděním kterékoli jeho části a funkční a morfologickou přestavbou.
Výskyt vícečetných fascikulačních potenciálů ve svalech je považován za jeden z hlavních příznaků poškození motorických neuronů míchy. Výjimkou jsou „benigní“ fascikulační potenciály, které jsou někdy detekovány u pacientů, kteří si stěžují na neustálé záškuby ve svalech, ale nezaznamenávají svalovou slabost ani jiné příznaky.
Jednotlivé fascikulační potenciály lze detekovat také u neurogenních a dokonce i primárních svalových onemocnění, jako je myotonie, polymyozitida, endokrinní, metabolické a mitochondriální myopatie.
Byly popsány fascikulační potenciály, které se vyskytují u vysoce kvalifikovaných sportovců po vyčerpávající fyzické zátěži. Mohou se vyskytnout i u zdravých, ale snadno vzrušivých lidí, u pacientů s tunelovým syndromem, polyneuropatiemi a u starších osob. Na rozdíl od onemocnění motorických neuronů je však jejich počet ve svalu velmi malý a parametry jsou obvykle normální.
Parametry fascikulačních potenciálů (amplituda a trvání) odpovídají parametrům MUAP zaznamenaného v daném svalu a mohou se měnit souběžně se změnami MUAP během vývoje onemocnění.
Jehlová elektromyografie v diagnostice onemocnění motorických neuronů míchy a periferních nervů
Jakákoli neurogenní patologie je doprovázena DRP, jejíž závažnost závisí na stupni poškození inervační zdroje a na úrovni periferního neuromotorického aparátu - neuronálního nebo axonálního - na které k poškození došlo. V obou případech se ztracená funkce obnoví díky přeživším nervovým vláknům, která se začnou intenzivně větvit a vytvářejí četné výhonky směřující k denervovaným svalovým vláknům. Toto větvení se v literatuře nazývá "rašení".
Existují dva hlavní typy sproutingu - kolaterální a terminální. Kolaterální sprouting je větvení axonů v oblasti Ranvierových uzlů, terminální sprouting je větvení konečného, nemyelinizovaného úseku axonu. Bylo prokázáno, že povaha sproutingu závisí na povaze faktoru, který způsobil narušení nervové kontroly. Například při botulinové intoxikaci dochází k větvení výhradně v terminální zóně a při chirurgické denervaci dochází k terminálnímu i kolaterálnímu sproutingu.
V elektromyografii jsou tyto stavy MU v různých fázích reinervačního procesu charakterizovány výskytem MUAP se zvýšenou amplitudou a trváním. Výjimkou jsou zcela počáteční fáze bulbární formy ALS, ve kterých jsou parametry MUAP v mezích normálních variací po dobu několika měsíců.
Elektromyografická kritéria pro onemocnění motorických neuronů míchy
- Přítomnost výrazných fascikulačních potenciálů (hlavní kritérium pro poškození motorických neuronů míchy).
- Zvýšení parametrů PDE a jejich polyfáze, odrážející závažnost procesu reinnervace.
- Výskyt spontánní aktivity svalových vláken ve svalech - PF a POV, což naznačuje přítomnost probíhajícího denervačního procesu.
Fascikulační potenciály jsou povinným elektrofyziologickým znakem poškození motorických neuronů míchy. Jsou detekovány již v nejranějších stádiích patologického procesu, ještě před objevením se známek denervace.
Vzhledem k tomu, že neuronální onemocnění zahrnují neustálý probíhající proces denervace a reinervace, když dojde k odumírání velkého počtu motorických neuronů a současnému zničení odpovídajícího počtu motorických neuronů (MU), MU se zvětšují, jejich trvání a amplituda se zvyšují. Stupeň nárůstu závisí na délce trvání a stádiu onemocnění.
Závažnost PF a POV závisí na závažnosti patologického procesu a stupni svalové denervace. U rychle progredujících onemocnění (například ALS) se PF a POV nacházejí ve většině svalů, u pomalu progredujících onemocnění (některé formy spinálních amyotrofií) pouze v polovině svalů a u post-polomyelitidového syndromu méně než v třetině.
Elektromyografická kritéria pro onemocnění periferních nervových axonů
Jehlová elektromyografie v diagnostice onemocnění periferních nervů je doplňkovou, ale nezbytnou vyšetřovací metodou, která určuje stupeň poškození svalu inervovaného postiženým nervem. Studie umožňuje objasnit přítomnost známek denervace (SF), stupeň ztráty svalových vláken ve svalu (celkový počet MUF a přítomnost obrovských MUF), závažnost reinervace a její účinnost (stupeň zvýšení parametrů MUF, maximální amplituda MUF ve svalu).
Hlavní elektromyografické znaky axonálního výběžku:
- zvýšení průměrné hodnoty amplitudy parciální diferenciální rovnice;
- přítomnost PF a POV (při současné denervaci);
- prodloužení doby trvání PDE (průměrná hodnota se může pohybovat v normálních mezích, tj. ±12 %);
- polyfázie PDE;
- jednotlivé fascikulační potenciály (ne v každém svalu).
V případě poškození axonů periferních nervů (různé polyneuropatie) se také vyskytuje DRP, ale jeho závažnost je mnohem menší než u neuronálních onemocnění. V důsledku toho jsou MUAP zvýšené v mnohem menší míře. Nicméně základní pravidlo změny MUAP u neurogenních onemocnění platí i pro poškození axonů motorických nervů (tj. stupeň zvýšení parametrů MUAP a jejich polyfáze závisí na stupni poškození nervů a závažnosti reinervace). Výjimkou jsou patologické stavy doprovázené rychlým odumíráním axonů motorických nervů v důsledku traumatu (nebo jiného patologického stavu vedoucího k odumírání velkého počtu axonů). V tomto případě se objevují stejné obří MUAP (s amplitudou více než 5000 μV) jako u neuronálních onemocnění. Takové MUAP jsou pozorovány u dlouhodobých forem axonální patologie, CIDP, nervových amyotrofií.
Pokud se u axonálních polyneuropatií amplituda MUAP zvyšuje především, pak se v demyelinizačním procesu se zhoršením funkčního stavu svalu (snížením jeho síly) průměrné hodnoty trvání MUAP postupně zvyšují; výrazně častěji než u axonálního procesu jsou detekovány polyfázické MUAP a fascikulační potenciály a méně často PF a POV.
 [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ]
[ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ], [ 42 ]
Jehlová elektromyografie v diagnostice synaptických a primárních svalových onemocnění
Synaptická a primární svalová onemocnění obvykle vykazují zkrácení průměrné doby trvání MUAP. Stupeň zkrácení doby trvání MUAP koreluje se snížením síly. V některých případech jsou parametry MUAP v normálním rozmezí a u PMD mohou být dokonce zvýšené.

