Restenóza
Naposledy posuzováno: 23.04.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
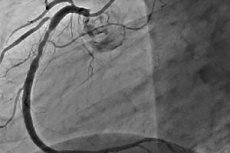
Restenóza je vývoj opakovaného zúžení o 50% nebo více v místě perkutánní koronární intervence. Restenóza je obvykle doprovázena relapsem angíny, která často vyžaduje opakované intervence. Vzhledem k tomu, že PCI se vyvinula, výskyt restenózy se snížil, navíc se její charakter změnil.
Restenóza po transluminální balonové koronární angioplastice (TBA)
Po provedení TBA je výskyt restenózy v prvních 6 měsících. Je 30-40%. Hlavním mechanismem jeho vývoj je místní negativní remodelaci plavidla, která je však ve skutečnosti, je pružné spadenie lumen tepny, balónek rozšířena v průběhu řízení. Relativní roli hraje i lokální trombóza a neointimální růst. Přidělit klinické (diabetes mellitus typu 2, akutní koronární syndrom (ACS), historie restenóza), angiografie (LAD lézi, malý průměr nádobky, chronické úplného uzavření (HTO), dlouhé léze, degenerovaný cévních štěpů) a čištění (vysoké zbytkové stenózy, malý nárůst průměru nádoba v důsledku nafouknutí balónku) rizikové faktory pro vznik restenózy po TBCA. V případě restenózy se zpravidla provádí opakovaná intervence. TBCA opakovaný přenos úspěch restenózy v místě srovnatelná s první postup. Avšak u každé následné TBCA pro restenózu se riziko opakování restenózy významně zvyšuje. Po třetím pokusu dosahuje 50 - 53%. Kromě toho, každý z opakovaného TBCA rozvíjející restenózy je výraznější než ten první. Rizikové faktory pro rozvoj restenózy po druhé TBCA restenózy jsou časný vzhled prvního restenózy (60-90 dní po zákroku), PNA porážka mnogososudistos léze, přítomnost diabetes mellitus 2. Typu, hypertenze, nestabilní anginy pectoris, jakož i vícenásobné inflace balónku na první postup. S ohledem na vysoký výskyt restenózy a mechanismus její vývoj v klinické praxi byly zavedeny koronární stenty, které teoreticky měly být eliminovány negativní cévní remodelace po TBCA.
První studie, které prokázaly účinnost použití stentů, byly publikovány v roce 1993, studie společnosti STRESS a BENESTENT. V BENESTENT zahrnovala 516 pacientů s nově diagnostikovanou stenózy koronárních tepen s průměrem větším než 3 mm, které byly náhodně rozděleny do dvou skupin: pravidelné TBCA (n = 257) TBCA a stent (n = 259). Po 3 letech byla míra restenózy s angiografií u konvenční skupiny TBCA 32% a ve skupině stentů 22%. Relativní snížení výskytu restenózy bylo 31% (p <0,01). V stenting skupině byl také snížit potřebu opakované revaskularizace myokardu (10 vs. 20,6% ve skupině s normální TBCA; p <0,01), který byl spojen s nižším výskytem opakování angíny ve stentu pásmu.
Podle STRES studie (n = 407) ve stentu skupině (n ~ 205) restenorirovaniya frekvence byla nižší než u konvenčních TBCA skupině (n = 202), - 31,6 vs 42,1% (p <0,01 ). Výhodou použití konvenčního angioplastiku stenty, než v případě, restenózy v místě TBCA REST byla prokázána ve studii, ve které bylo 383 pacientů s restenózy randomizováni stentu, nebo re-perkutánní transluminální koronární angioplastice. Angiograficky detekovatelná restenóza byla nižší o 18% ve stentu (18 vs 5,32%; p <0,03). Opakované revaskularizaci myokardu, což je indikátorem klinicky významné restenózy požadované také významně nižší ve skupině pacientů, kteří podstoupili zavedení stentu (10 versus 27%, p <0,001). To znamená, že nejlepší výsledky při používání stentu byla prokázána nejenom v nativních tepen, ale také v případě zásahu na restenóza vyvíjet po TBCA.
Restenóza po implantaci nekrytého stentu (NPC)
Ačkoli nepovlečené koronární stenty se snížil výskyt restenózy v porovnání s TBCA 30-40%, 17 -32% pacientů, a to i po stenting restenózy již vyvinuté uvnitř stentu, který vyžaduje revaskularizaci. Mechanismus vývoje vnitřní stenózy (HRV) se liší od mechanismu TBA. Po stenting hlavní příspěvek k tomu, aby restenózy tvorby neointimy, spíše než negativní remodelaci jako v TBCA, který v místě implantace stentu prakticky chybí. Neointimy je tvořena migrace a proliferace buněk produkujících gladkomyshechpyh ekstratsellyulyarpy matrici, která spolu s buňkami a neointimy. Navíc je u diabetických pacientů důležitá i přetrvávání trombu v místě stentingu.
Hlavní klasifikace stentu stenózu (HRV) je klasifikace navrhované mehran, který obsahuje čtyři typy v závislosti na rozsahu a závažnosti lézí: I HRV typ - lokální (
Rizikové faktory pro vývoj zbraní hromadného ničení jsou intervenční pas žilní štěpy, chronické uzávěry, v ústí řek léze, malý průměr plavidla, přítomnost zbytkového stenózy, stenting o ZHN, malý průměr postprotsedurny nádoba, PNA odpojovacích, velká délka stentu, přítomnost diabetu, implantace více stentů v jedné porážce . Existují náznaky vlivu genetických faktorů, zejména glykoproteinu lila polymorfismu a genové mutace methylentetrahydrofolát reduktázy - genu kódujícího interleukinu-1. V případě okraje stentu restenózy je hlavním rizikovým faktorem pro aterosklerotické léze vyjádřené v stentiruemom segmentu.
Převážně dochází k restenosu během prvních 6-8 měsíců. Po perkutánní koronární intervenci. U většiny pacientů ve stejnou dobu existují klinické příznaky. Obvykle se HRV projevuje jako relaps na anginu pectoris. Méně časté (11-41% případů) je nestabilní angina pectoris. U 1-6% pacientů se rozvíjí AMI. To je nejčastější příčina anginy během 1-6 měsíců. Po stentování je vývoj HRV, který zpravidla vyžaduje opakovanou revaskularizaci. Existuje několik způsobů léčby HRV. Je možné provádět běžné TBCA, což vede k dalšímu zpřístupnění stentu (zvýšení 56% příspěvku do konečného průměru nádoby), a také tlačí na buňky prostřednictvím stentu neointimy (44% podíl na konečné zvýšení v průměru). Zbytková restenóza je však z větší části pozorována v místě intervence (v průměru 18%). Kromě toho, po TBCA revaskularizace je nutné v 11% případů, často u pacientů s postižením více onemocnění, nízkou ejekční frakce levé komory, v případě, že intervence na žilních zkratů první nebo brzy výskyt HRV. Riziko vývoje recidivující HRV po TBCA závisí také na typu léze a pohybuje se od 10% v případě lokální restenózy po 80% s invazivním okluzí. Implantace NPC místo HRV nezmenšuje riziko jeho opakování ve srovnání pouze s TBA.
Druhá metoda je léčba HRV brachyterapie, který zahrnuje podávání radioaktivní zdroj lumen věnčitých tepen, zabraňuje proliferaci buněk hladkého svalstva, a proto snížení rizika restenózy. Nicméně vysoká cena zařízení, technická složitost postupu a zvýšená frekvence trombózy pozdního stentu (TC) téměř zcela vyloučily brachyterapii z klinického použití.
Revolučním momentem léčby VRS bylo zavedení stentů s elucí léků. Ve srovnání s nativním NAP v případě, že snížení arteriálního 70-80% riziko HRV prvních údajů o SLP účinnosti u pacientů s již vyvinuté HRV byly získány u pacientů registrovat TAXUS III, kde použití SPG1 u těchto pacientů po 6 měsících. Míra recidivy HRV byla pouze 16%, což je nižší než u dříve zmíněných studií s TBA. V registru TRUE, který zahrnoval pacienty po implantaci ATP pro restenózu NPC, po 9 měsících. Opakovaná revaskularizace byla vyžadována u méně než 5% pacientů, zejména u diabetiků a ACS. TROPICAL Studie porovnávala výskyt restenózy u pacientů po implantaci v místě restenózy DES dat pro výzkum GAMMA I a gama II, ve kterém E představuje způsob léčby aplikované brachyterapie. Po 6 měsících. Incidence restenózy byla významně nižší u skupiny ATP (9,7 vs. 40,3%, p <0,0001). Důležité je, že frekvence stentu trombózy, infarktu myokardu byl také nižší ve skupině ATP (TS 0,6% oproti 3,9, p = 0,08; MI - 1,8 vs. 9,4%, p = 0,004). Výhodou ATP předchozího brachyterapii byla potvrzena v randomizované SISR studie, ve které 384 pacientů se zjištěnou HRV v HPC byl randomizovaný ATP nebo brachyterapeutický implantaci. Po 9 měsících. že je třeba pro opakované revaskularizace byla vyšší po brachyterapie (19,2%) než ve skupině implantován PCA (8,5%), což odráží častější recidivy restenózy. Po 3 letech ATP výhodu, pokud jde o snižování potřeby opakované revaskularizace pro opakující se stent restenózy přetrvávalo (19 vs. 28,4%). Nebyl zjištěn žádný významný rozdíl ve výskytu trombózy mezi skupinami.
Hlavními faktory pro obnovení HRV u pacientů s NPC v případě ATP implantace jsou malý průměr nádoby (<2,5 mm), difúzní typ restenózy, stejně jako přítomnost chronického selhání ledvin vyžadující dialýzu. V randomizované studii Taxus V ISR CPR také prokázaly vysokou účinnost při léčbě HRV, snížení brachyterapie ve srovnání s frekvencí opakování restenózy o 54%.
Byly provedeny také randomizované studie porovnávající účinnost TBA pro implantaci HRV a SLP. V randomizované studii RIBS-II po 9 měsících. Restenóza o 72% zřídka setkal po implantaci SLP než po TBCA, čímž se snižuje nutnost opakovaných revaskularizací od 30 do 11%. Ve studii ISAR DESIRE byla účinnost TBA v HRV porovnána s implantací SPP nebo ATP. Po 6 měsících. Ukázalo se, že jak BLT prevenci restenózy účinněji než TBCA (rychlost vývoje byla 44,6% při TBCA, 14,3% ve skupině ATP a 21,7% ve skupině KPR), což snížilo potřebu opakovaného revaskularizaci. V přímém srovnání s CPR, a ATP bylo zjištěno, že ATP snížit potřebu opakované revaskularizace významně účinnější než WBS (19% vs 8). Tak, implantace SLP snižuje výskyt recidivy HRV NPS ve srovnání jak s TBCA a brachyterapie, která snižuje počet opakovaných přenosů dělá PCI, a tedy i implantační postup volby u těchto pacientů.
Restenóza po implantaci stentu s elucí léků (SLP)
Přes 70-80% snížení výskytu intrastenální stenózy při použití SLP v porovnání s NPC, nemohly zcela vyloučit vývoj tohoto iatrogenního účinku stentingu. Jeho celková frekvence zůstává v průměru nižší než 10%. Kromě kvantitativního snížení výskytu restenózy také významně změnily typ restenózy, která se tvoří. Takže po implantaci SLP je restenóza zpravidla ohnisková. Klinicky, jako v případě NPS, se nejčastěji projevuje jako relaps ke stabilní anginu pectoris (77%), méně často (8%), je asymptomatická. V 5% případů se projevuje nestabilní angina a u 10% - prvním příznakem je infarkt myokardu bez Q. Hlavní faktory pro vývoj restenózy SLP jsou diabetes typu 2, malý průměr plazmy, stejně jako rozsah léze. Jasná doporučení týkající se řízení těchto pacientů nejsou. Alternativy jsou opakovaná implantace SLP (stejného typu nebo jiného typu), vedení TBA nebo brachyterapie. Průměrná frekvence vývoje restenózy během implantace druhého SLP je 24%, zatímco v případě implantace stejného typu SLP nebo jiného je stejná.


 [
[