Lékařský expert článku
Nové publikace
Léky
Léky zabraňující trombóze a zlepšující reologii krve
Naposledy posuzováno: 07.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
V prevenci tvorby mnohočetných mikrotrombů během šoku a jejich destrukce lze použít různé farmakologické přístupy, které využívají léky, jež zabraňují tvorbě trombů a zlepšují reologii krve:
- eliminace systémových hemodynamických a mikrocirkulačních poruch pomocí vazoaktivních a inotropních látek;
- opatření ke zlepšení reologie krve pomocí racionální infuzní terapie a léků, které obnovují elasticitu membrán erytrocytů (trental nebo pentoxifylin);
- prevence agregace krevních destiček a tvorby počátečních „bílých“ trombů v malých arteriálních cévách s následnou iniciací koagulační kaskády;
- inhibice tvorby trombů po aktivaci systémové koagulační kaskády;
- aktivace fibrinolýzy s cílem rozpustit nově vytvořené krevní sraženiny (fibrinolysin, streptokináza, streptodekáza, urokináza atd.) nebo naopak inhibice fibrinolýzy při její generalizaci u některých pacientů s traumatickým šokem a sepsí (kyselina aminokapronová, amben, kontrikal atd.).
Většina uvedených přístupů je tradiční, v praxi léčby šoku dobře rozvinutá, má své vlastní hemoreologické indikace a je specifikována v příslušných kapitolách. Proto je v této části vhodné se zaměřit na úvahu o obecném přístupu k prevenci tvorby trombů v šoku pomocí farmakologických látek ovlivňujících profázi krevní koagulace. Právě tato úroveň prevence koagulačních komplikací - výskyt, tvorba a růst „bílých arteriálních trombů“ - přitahuje největší pozornost výzkumníků.
Pro různé typy šoku jsou charakteristické různé a často vícesměrné poruchy srážlivosti krve se zhoršením její reologie. Nejcharakterističtější pro septický, endotoxinový, popáleninový, traumatický a hemoragický typ šoku je tvorba mnohočetných mikrotrombů v nejmenších cévách, způsobená poruchami systémové hemodynamiky, vazospasmem a poruchami mikrocirkulace, houstnutím krve, kalem, sníženou elasticitou membrán erytrocytů, jakož i četnými obecnými i lokálními faktory (autokoidy) iniciujícími lokální změny koagulační hemostázy a zahrnutím profáze srážení krve.
Ve schematické (zkrácené) podobě je počáteční fáze hemokoagulace a mechanismus lokální hemokoagulační homeostázy prezentován následovně.
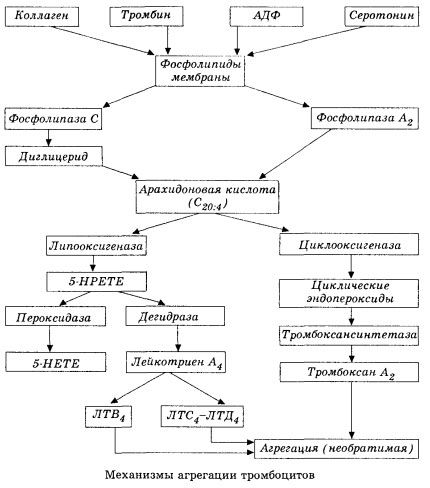
Začíná aktivací membránové fosfolipázy A2 v důsledku působení kombinace poškozujících faktorů (přímé poškození membrány, hypoxie, peroxidace lipidů, působení endogenních chemických faktorů atd.). V důsledku rozpadu membránových fosfolipidů se uvolňují neesterifikované mastné kyseliny s dlouhým řetězcem, z nichž nejdůležitější je kyselina arachidonová jako výchozí substrát. Její transformace (kaskáda kyseliny arachidonové) probíhá lipoxygenázovou (syntéza leukotrienů) a cyklooxygenázovou (syntéza prostaglandinů, tromboxanů, prostacyklinů) drahami.
Vzniklé leukotrieny (B4, C4, E4, D4 atd.) - látky s extrémně vysokou biologickou aktivitou, mezi které patří i pomalu reagující látka anafylaxe - mají velký význam při iniciaci lokálních cévních, zánětlivých a imunitních reakcí, včetně autoimunitních procesů. Leukotrieny způsobují poruchy mikrocirkulace, zvýšenou srážlivost krve, uvolňování autolytických lysozomálních enzymů a uvolňování faktoru, který inhibuje kontraktilitu myokardu a bronchiální spasmus, do krve.
Vzhledem ke své schopnosti vyvolat kontrakci hladkého svalstva leukotrieny významně ovlivňují systémovou hemodynamiku, koronární cévy a myokard, přičemž vyvíjejí silný koronární konstrikční a negativně inotropní účinek, který je doprovázen snížením srdečního výdeje a hraje důležitou roli ve vývoji hypotenze.
Snížený srdeční výdej a hypotenzní reakce na leukotrieny jsou spojeny s oslabením srdečního svalu a omezením žilního návratu do srdce. Významný význam pro omezení žilního návratu má schopnost leukotrienů zvyšovat propustnost cévní stěny a způsobovat extravazaci plazmy. Leukotrieny jsou považovány za důležité v patogenezi infarktu myokardu.
U anafylaktického a septického (endotoxinového) šoku jejich role zřejmě ještě roste, o čemž svědčí schopnost leukotrienů hromadit se ve významném množství v plazmě během alergických reakcí a způsobovat změny systémového průtoku krve charakteristické pro anafylaktický šok, stejně jako ochranné účinky blokátorů leukotrienových receptorů a inhibitorů lipoxygenázy. Vývoj selektivních blokátorů leukotrienových receptorů probíhá poměrně intenzivně a je slibným směrem vědy. V této oblasti již bylo dosaženo určitých úspěchů a účinnost těchto blokátorů při ischemii myokardu, endotoxinovém a hemoragickém šoku byla experimentálně potvrzena. Než však bude tento směr klinicky implementován, bude pravděpodobně trvat ještě několik let.
Pokud se v žilních cévách tromby tvoří za stejné účasti trombocytů a plazmatických koagulačních faktorů, pak v tepnách jsou hlavními iniciátory procesu trombocyty. Obsahují ADP, Ca2+, serotonin, fosfolipidy, enzymy syntézy prostaglandinů a tromboxanu, trombostenin (stejně jako svalový aktomyosin zajišťuje kontraktilní schopnost těchto buněk), trombogenní růstový faktor epitelu a svalových buněk cévní stěny a řadu dalších látek. Humorální regulace funkcí trombocytů se provádí prostřednictvím specializovaných receptorů jejich membrán (alfa2- a beta2-adrenoreceptory, receptory pro histamin a serotonin, acetylcholin, tromboxan, adenosin a řada dalších). Zvláštní vlastností trombocytů je vysoká afinita ke kolagenu a dalším subendoteliálním prvkům cévní stěny, k nesmáčivým a negativně nabitým povrchům. Tato vlastnost poskytuje trombocytům výjimečnou schopnost adherovat (přilnout) k úseku cévy s poškozeným endotelem, který má dostatek možností k poškození během šoku. V tomto případě se trombocyty rozprostřou a uvolní pseudopodie, které mohou přilnout k sobě navzájem a ke stěně cévy. Propustnost membrány se zvyšuje a z trombocytů se uvolňuje ADP, serotonin, tromboxan a některé koagulační faktory adsorbované na povrchu trombocytu. Tyto látky interagují s odpovídajícími receptory na membráně a za účasti iontů vápníku způsobují agregaci (zpočátku reverzibilní). Proces se stává soběstačným, což je usnadněno humorálními regulačními faktory; jiné faktory jej naopak mohou zastavit a dokonce zvrátit, což způsobuje disagregaci.
S převahou vlivů a podmínek tvořících tromby jsou fáze adheze a reverzibilní agregace nahrazeny třetí fází - ireverzibilní agregací, která se provádí za účasti trombosteninu a vede ke zúžení sraženiny; reakce zesílení agregantu a zúžení probíhá také za účasti Ca+, ATP a vede k tvorbě bílého trombu.
Cyklooxygenázová dráha přeměny kyseliny arachidonové v krevních destičkách, vaskulárních endoteliálních buňkách a dalších tkáních zajišťuje lokální (poločas rozpadu metabolitů je velmi krátký) koagulační homeostázu, protože během tohoto metabolismu se tvoří silné pro- a antiagregační látky. Hlavním faktorem aktivujícím agregaci krevních destiček v cyklooxygenázovém řetězci reakcí je tromboxan A2 a jeho neméně silným antagonistou je prostacyklin, produkovaný endoteliálními buňkami a v menší míře prostaglandiny řady E a G. Agregaci krevních destiček silně ovlivňují i další lokální a systémové humorální faktory.
Aktivátory a inhibitory agregace krevních destiček
Iniciátory a aktivátory agregace krevních destiček |
Inhibitory agregace krevních destiček |
Kolagen |
- |
ADP |
Adenosin a jeho stabilizátory |
Norepinefrin (přes alfa2 receptory) |
Alfa-adrenergní blokátory |
Serotonin |
Antiserotoninové látky |
Histamin |
Antihistaminika |
Trombin |
Heparin |
Ca2+ |
Antagonisté Ca2+ |
CGMP - jeho induktory (acetylcholin?) a stabilizátory |
CAM - její induktory (prostřednictvím beta-adrenergních receptorů) a stabilizátory (inhibitory fosfodiesterázy) |
Kyselina arachidonová |
Dextrany, albumin |
Tromboxan A2 |
Prostacyklin I2 |
Farmakologické intervence v počáteční fázi tvorby trombu při šoku a akutních ischemických procesech v srdci a mozku naznačují následující možnost:
- inhibice počátečních reakcí (úplných a částečných) kaskády kyseliny arachidonové;
- inhibice specifické reakce syntézy tromboxanu;
- blokáda receptorů pro leukotrieny a tromboxany v krevních destičkách, hladkém svalstvu a dalších buňkách;
- použití látek, které modulují agregaci krevních destiček, tj. jinými způsoby oslabují jejich reakci na vliv iniciačních faktorů (kolagen, tromboxan A2, leukotrieny atd.).
Zavedení uvedených způsobů korekce poruch reologických vlastností krve umožňuje řešení hlavního taktického úkolu: chránit receptory agregace a adheze krevních destiček před účinkem aktivátorů nebo potlačit intracelulární mechanismy syntézy těchto receptorů. Inhibice počátečních reakcí kaskády kyseliny arachidonové lze dosáhnout ochranou receptorů krevních destiček, které reagují na polymerní aktivátory, pomocí nízkomolekulárních dextranů, jejichž molekuly konkurují fibrinu, kolagenu, agregovanému imunoglobulinu (IgE) a složkám komplementového systému.
Nízkomolekulární dextrany maskují receptory na membráně krevních destiček a konkurují velkorozměrným proteinům na povrchu erytrocytů, čímž je vytlačují a ničí můstky mezi buňkami. To je způsobeno tím, že dextrany, obalující cévní endotel a povrch krevních buněčných elementů, zvyšují jejich negativní náboj, a tím posilují antiagregační vlastnosti.
Dextrany
Nízkomolekulární dextrany snižují agregaci krevních destiček indukovanou kolagenem a ADP, stejně jako aktivační účinek trombinu na krevní destičky, inhibují růst počátečního trombu z bílých krevních destiček, zlepšují průtok krve, snižují pooperační zvýšení obsahu fibrinogenu v plazmě a mění strukturu a stabilitu fibrinu.
Intravenózní infuze dextranů při traumatu a šoku nejen snižují agregaci a adhezi krevních destiček, ale také mobilizují endogenní heparin, čímž podporují tvorbu řídké a špatně retrahovatelné krevní sraženiny, kterou snadno lyzují fibrinolytika. Antitrombinová aktivita nízkomolekulárních dextranů je spojena s jejich specifickým účinkem na strukturu a funkci krevního koagulačního faktoru VIII. Faktor VIII (antihemofilní globulin), velká molekula se složitou strukturou a funkcí, se podílí na agregaci krevních destiček a stabilitě výsledné sraženiny. Dextrany interferují s účinkem faktoru VIII, čímž zpomalují agregaci krevních destiček a snižují stabilitu sraženiny.
Nízkomolekulární dextrany nejsou pravými antikoagulancii a jejich korekční účinek u hemoreologických poruch je spojen především s hemodilucí, doplněním objemu cirkulující plazmy a zlepšením průtoku krve v mikrocirkulačním systému.
Schopnost dextranů zlepšit průtok krve při hemodynamických poruchách (šok, ztráta krve) je dána komplexem faktorů. Výskyt vysoké přechodné koncentrace polymeru v krvi vede nejen k „přímé hemodiluci“, ale také vytváří podmínky pro tok tekutiny do krevního oběhu z intersticiálního prostoru a následné vyrovnání osmotického účinku dextranu. V důsledku hemodiluce se snižuje viskozita krve, zvyšuje se žilní přítok do srdce a zvyšuje se srdeční výdej. Spolu s těmito účinky dextrany tvoří komplexy s fibrinogenem a mají antilipemický účinek.
Antiagregační účinek a hemodynamické účinky nízkomolekulárních dextranů tak pomáhají snižovat viskozitu krve, což je obzvláště důležité při nízkých smykových rychlostech. Disagregace krevních buněk zlepšuje systémový průtok krve a mikrocirkulaci, zejména v její žilní části, kde jsou rychlostní gradienty nejnižší. Použití roztoků nízkomolekulárních dextranů u různých typů šoku, během chirurgické léčby poranění a jejich následků a poté v pooperačním období pomáhá předcházet hyperkoagulaci a snižovat pravděpodobnost trombotických procesů a embolie.
Je však třeba poznamenat, že v některých případech jsou infuze dextranových roztoků doprovázeny anafylaktickými a alergickými reakcemi (nebezpečné při senzibilizaci a anafylaktickém šoku). To je dáno tím, že dextrany, které mají velkou molekulovou hmotnost a mnoho postranních řetězců, mohou působit jako antigen. Proto se pro stanovení individuální citlivosti doporučuje předem podat intravenózně až 20 ml nízkomolekulárního roztoku dextranu jako hapten (15% roztok, molekulová hmotnost 1000) a před zavedením anestezie provést infuze plazmatické náhrady.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Inhibitory trombinu
Farmakologické ochrany receptorů krevních destiček interagujících s aktivátory krevních destiček lze dosáhnout také pomocí látek, které konkurují nepolymerním aktivátorům krevních destiček nebo je inhibují. Mezi takové látky patří inhibitory trombinu (heparin a hirudin, řada syntetických inhibitorů, antagonisté adrenalinu), blokátory alfa-receptorů (fentolamin, dihydroergotamin), antagonisté ADP (dipyridamol, adenosin a jeho strukturní analogy, kreatinfosforečnan), antagonisté serotoninu (methysergid). Pouze několik z uvedených látek se skutečně používá k prevenci a léčbě šoku různého původu.
Ochrana intracelulárních mechanismů syntézy proteinových receptorů, které reagují s aktivátory agregace a adheze krevních destiček, a inhibice procesů syntézy tromboxanu je možná pomocí léků různých skupin:
- induktory a stabilizátory cATP, prostacyklinu a prostaglandinu PgE2;
- inhibitory fosfolipázy a fosfodiesterázy.
Intenzivní vývoj speciálních antiagregačních látek začal relativně nedávno a dosud nevedl ke spolehlivým výsledkům. V současné době se v klinické praxi kromě dextranových roztoků široce používají antiagregační látky, jako je kyselina acetylsalicylová, indomethacin, dipyradamol, sulfinpyrazon (persantin), prostacyklin (eikoprostenon) a heparin, k prevenci tvorby bílých krevních destiček.
Nesteroidní protizánětlivé léky
Bylo prokázáno, že farmakologické účinky nesteroidních protizánětlivých léků - kyseliny acetylsalicylové a indomethacinu - jsou způsobeny jejich vlivem na metabolismus eikosanoidů (tromboxanů a prostaglandinů). Téměř všechny léky v této skupině inhibují enzymový komplex známý jako prostaglandin syntetáza, čímž uplatňují své specifické a antiagregační účinky.
Kyselina acetylsalicylová se po perorálním podání velmi rychle vstřebává. Produkt její hydrolýzy, kyselina salicylová, způsobuje inhibici cyklooxygenázy krevních destiček, což narušuje přeměnu kyseliny arachidonové na prostaglandin O2 a nakonec tromboxan A2. Kyselina acetylsalicylová inhibuje agregaci indukovanou kolagenem, ADP, adrenalinem a serotoninem. Ačkoli její GG05 je 15 minut, antiagregační účinek trvá několik dní, což je zřejmě vysvětleno ireverzibilní inhibicí reakcí syntézy prostaglandinů a potlačením funkce agregace krevních destiček po celou dobu jejich života (6-10 dní). Spolu s inhibicí cyklooxygenázy krevních destiček inhibuje kyselina acetylsalicylová ve vysokých dávkách cyklooxygenázu cévní stěny a současně s potlačením syntézy tromboxanu A2 inhibuje syntézu prostacyklinu v endoteliálních buňkách. Proto by měla být kyselina acetylsalicylová předepisována jako antiagregační látka v malých dávkách (3000-5000 mg/den), které převážně inhibují agregaci krevních destiček.
Vzhledem k tomu, že kyselina acetylsalicylová blokuje cyklooxygenázu krevních destiček po dobu několika dní a endoteliální cyklooxygenázu ne déle než jeden den, je racionální předepisovat lék ne denně, ale každé 3-4 dny. Výběr optimální dávky kyseliny acetylsalicylové pro pacienta by měl být prováděn individuálně, protože citlivost pacientů na antiagregační účinek léku se liší. U reaktivních pacientů kyselina acetylsalicylová v dávce 0,5 g inhibuje agregaci krevních destiček o 40-50 %, u hyperreaktivních pacientů úplně nebo o 80-90 % a u reaktivních pacientů je při užívání stejné dávky léku charakteristická absence antiagregačního účinku.
Selektivními inhibitory tromboxan syntetázy jsou imidazol a jeho analogy, které neblokují cyklooxygenázu. Dipyridamol, používaný v klinické praxi při léčbě chronické ischemické choroby srdeční jako koronární dilatátor, stejně jako imidazol selektivně inhibuje tromboxan syntetázu, čímž zabraňuje syntéze tromboxanu A2. Předpokládá se, že lék a jeho analogy také inhibují destičkovou fosfodiesterázu, čímž zvyšují koncentraci cAMP v krevních destičkách. Spolu s tím dipyridamol inhibuje aktivitu adenosin deaminázy a vychytávání adenosinu krevními destičkami, blokuje absorpci serotoninu krevními destičkami a jejich agregaci indukovanou adrenalinem a kolagenem. Existují zprávy o slabé antiagregační aktivitě léku a jeho schopnosti v malých dávkách zvyšovat agregaci krevních destiček. Nejspolehlivějšího antiagregačního účinku lze dosáhnout kombinací dipyridamolu a kyseliny acetylsalicylové.
Heparin
Mezi antitrombotiky je jedním z nejúčinnějších regulátorů agregátního stavu krve heparin, zejména při jeho časném použití. Heparin má vysoký negativní náboj a je schopen interagovat s velkými i malými ionty a molekulami (enzymy, hormony, biogenní aminy, plazmatické proteiny atd.), takže spektrum jeho biologického účinku je poměrně široké. Léčivo má antitrombinové, antitromboplastinové a antiprotrombinové účinky, zabraňuje přeměně fibrinogenu na fibrin, potlačuje retrakci sraženiny a zvyšuje fibrinolýzu.
Mechanismus antikoagulačního účinku heparinu je poměrně složitý. Nyní bylo zjištěno, že antikoagulační účinky heparinu jsou spojeny s potenciací účinku antitrombinu III a zvýšením schopnosti komplexu heparin-antitrombin III rychle inaktivovat většinu serinových proteáz systému srážení krve. V antitrombotickém účinku heparinu má velký význam jeho schopnost zvyšovat a udržovat vysoký elektronegativní potenciál cévní intimy, čímž zabraňuje adhezi krevních destiček a tvorbě jejich mikrotrombů. Heparin nejaktivněji potlačuje tvorbu trombů v žilách, čímž zabraňuje jak lokální tvorbě trombů, tak diseminované intravaskulární koagulaci.
Prostacyklin a jeho stabilní analogy
Mezi antiagregačními látkami jsou nejúčinnějšími inhibitory agregace prostacyklin a jeho stabilní analogy. Antiagregační účinek prostacyklinu je způsoben stimulací adenylátcyklázy a v důsledku toho zvýšením koncentrace cAMP v krevních destičkách, snížením obsahu tromboxanu, snížením obsahu tromboxanu A2 a blokádou jeho receptorů. Prostacyklin je nestabilní a rychle se hydrolyzuje na neaktivní produkty, proto se podává intravenózně kapačkou rychlostí 2 až 20 ng/kg za minutu po dobu 30-60 minut až 6krát denně.
Prostacyklin má spolu se silným antiagregačním účinkem i silný vazodilatační a bronchodilatační účinek. Lék rozšiřuje cévy mozku, srdce, ledvin, kosterních svalů a mezenterických cév. Pod vlivem prostacyklinu se zvyšuje koronární průtok krve, zvyšuje se energetické zásobení myokardu a snižuje se jeho potřeba kyslíku. Navzdory jeho nestabilitě v organismu mohou klinicky příznivé účinky přetrvávat několik týdnů a dokonce i měsíců. Mechanismus takového prodlouženého účinku není dosud jasný.
Prostacyklin je málo toxický lék, ale jeho užívání může způsobovat nežádoucí účinky: zarudnutí obličeje, bolesti hlavy, snížený krevní tlak, bolesti břicha, nechutenství. Spolu s prostacyklinem jsou jeho syntetické stabilní analogy (iloprost atd.) slibnými inhibitory agregace krevních destiček.
Léky, které zlepšují viskozitu krve
Poruchy reologických vlastností krve během traumatu a šoku jsou způsobeny nejen změnami funkční aktivity krevních destiček, ale také zvýšením viskozity krve. Strukturální viskozita krve jako komplexního dynamického disperzního systému je do značné míry určena viskozitou plazmy a schopností erytrocytů se deformovat. Viskozita plazmy závisí především na koncentraci bílkovin v krvi. Proteiny s malou molekulovou hmotností, jako je albumin, mají malý vliv na viskozitu plazmy, zatímco proteiny s velkou molekulou (fibrinogen, alfa- a gama-globuliny, další makromolekuly) ji významně zvyšují.
Při nízkých smykových rychlostech vede adsorpce fibrinogenu a globulinů na povrchu erytrocytů k tvorbě můstků mezi sousedními buňkami a k tvorbě agregátů z erytrocytů. Rychlost tvorby agregátů je složitý biofyzikální proces a závisí nejen na velikosti smyku, ale také na elektrokinetických vlastnostech erytrocytů, koncentraci, hmotnosti a sorpční kapacitě makromolekul-agregátorů, na tvaru a plasticitě erytrocytů.
Udržování tvaru a mechanických vlastností membrány erytrocytů vyžaduje značný energetický výdej. Předpokládá se, že energie produkovaná v erytrocytech během glykolýzy se vynakládá na fosforylaci spektrinu, což má za následek změny v sekundární struktuře proteinu a interakci se sousedními složkami vnitřní membrány. Interakce mezi strukturními proteiny membrány, spektrinem a aktinem, hraje důležitou roli při formování mechanických vlastností membrány erytrocytů, při udržování konstantního povrchu erytrocytu a jeho tloušťky při jakékoli deformaci.
V případě systémových hemodynamických a orgánových poruch krevního oběhu vede zvýšení rigidity erytrocytárních membrán a tvorba erytrocytárních agregátů ke snížení rychlosti průchodu erytrocytů kapilárami, čímž se narušuje funkce krevního transportu plynů. Proto by korekce poruch reologických vlastností krve v šoku měla zahrnovat kromě prevence agregace erytrocytů i normalizaci viskozity plazmy a krve, agregace a deformace erytrocytů.
Kromě nízkomolekulárních dextranů jsou roztoky albuminu jedním z účinných prostředků ke zvýšení stability krevní suspenze. V pozdním období šoku dochází k generalizované agregaci erytrocytů na pozadí snížení koncentrace albuminu v krevní plazmě a zvýšení koncentrace fibrinogenu a globulinů, zejména alfa2 frakce, lipoproteinů a lipidů. Za těchto podmínek jsou reologické účinky albuminu způsobeny dvěma hlavními faktory: hemodilucí a normalizací poměru mezi mikro- a makroglobulárními proteiny v plazmě. Zároveň albumin váže volné kyseliny, jejichž labilizace během traumatu a šoku stimuluje agregaci buněčných struktur krve a intravaskulární koagulaci a může způsobit tukovou embolii.
Protišoková opatření zaměřená na doplnění objemu cirkulující krve, odstranění tkáňové hypoxie a metabolické acidózy přispívají k normalizaci elasticity erytrocytárních membrán, protože hypoxie a acidóza významně snižují deformovatelnost erytrocytů. Zvýšená rigidita erytrocytárních membrán v šoku je pravděpodobně spojena s inhibicí syntézy ATP v erytrocytech. Snížení koncentrace ATP zase přispívá ke zvýšení koncentrace Ca2+ v erytrocytech, který vazbou na membránové proteiny zvyšuje rigiditu membrány.
Jedním z farmakologických léků, které zvyšují obsah ATP v erytrocytech a elasticitu erytrocytárních membrán, je Trental (pentoxifylin), který se v klinické praxi používá k léčbě ischemických poruch.
Spolu se snížením rigidity membrán erytrocytů způsobuje Trental vazodilataci, zlepšuje okysličení tkání, inhibuje aktivitu fosfodiesterázy v tkáních, zvyšuje koncentraci cAMP a inhibuje agregaci krevních destiček.
Z dalších farmakologických látek, které udržují elasticitu membrány erytrocytů, stojí za zmínku antagonisté Ca2+, kteří omezují tok iontů do erytrocytů (flunarizin, nifedipin atd.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Pozor!
Pro zjednodušení vnímání informací byl tento návod k použití drogy "Léky zabraňující trombóze a zlepšující reologii krve" přeložen a předložen ve zvláštním formuláři na základě oficiálních pokynů pro lékařské použití drogy. Před použitím si přečtěte anotaci, která přichází přímo k léčbě.
Popis je poskytován pro informační účely a není vodítkem pro samoléčení. Potřeba tohoto léčiva, účel léčebného režimu, způsobů a dávky léčiva určuje pouze ošetřující lékař. Samodržení je nebezpečné pro vaše zdraví.

