Lékařský expert článku
Nové publikace
Vzteklina u dětí
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Vzteklina neboli hydrofobie je akutní virové onemocnění přenášené kousnutím nakaženým zvířetem, s poškozením nervové soustavy a rozvojem těžké encefalitidy s fatálním koncem.
Epidemiologie
Virus vztekliny, který je od pradávna metlou veřejného zdraví, v současnosti způsobuje přibližně 59 000 lidských úmrtí ročně, přičemž téměř všechna tato úmrtí jsou přenášena kousnutím psem. To má významný ekonomický dopad na rozvojové země, zejména v Africe a Asii, které mohou takové ztráty snést nejméně. Navzdory téměř 100% úmrtnosti je však vzteklina u psů zcela preventabilním onemocněním a historické příklady eradikace vztekliny u psů v rozvinutém světě to potvrzují. [ 1 ]
Příčiny vzteklina
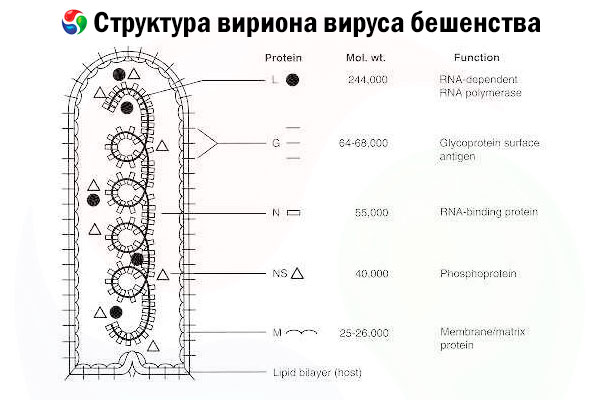
Původcem je virus vztekliny (RV), negativně vázaný RNA virus z čeledi rhabdovirů o velikosti přibližně 60 nm × 180 nm.
Skládá se z vnitřního proteinového jádra neboli nukleokapsidy obsahující nukleovou kyselinu a vnější membrány, dvojvrstvy obsahující lipidy pokryté transmembránovými glykoproteinovými hroty. Má relativně jednoduchou modulární strukturu genomu a kóduje pět strukturních proteinů:
- RNA-dependentní RNA polymeráza (L),
- nukleoprotein (N),
- fosforylovaný protein (P),
- matrixový protein (M) a
- glykoprotein vnějšího povrchu (G).
Proteiny N, P a L spolu s genomovou RNA tvoří ribonukleoproteinový komplex. G je jediný antigen RV schopný indukovat produkci neutralizačních protilátek proti RV, které jsou hlavními imunitními efektory proti letální infekci RV. Na druhou stranu se ukázalo, že ribonukleoproteinový komplex je hlavním antigenem RV schopným indukovat CD4+ T buňky, což může zvýšit produkci neutralizačních protilátek proti RV prostřednictvím intrastrukturálního rozpoznávání antigenu.[ 2 ] Ribonukleoproteinový komplex může hrát důležitou roli při budování imunologické paměti a dlouhodobé imunity.[ 3 ]
Klasifikace a typy antigenů
Rod Lyssavirus zahrnuje virus vztekliny a antigenně a geneticky příbuzné viry vztekliny: viry netopýrů Lagos, Mokola a Duvenhage, a také dva domnělé podtypy evropských lyssavirů netopýrů. Studie křížové ochrany naznačují, že zvířata imunizovaná tradičními vakcínami proti vzteklině nemusí být plně chráněna při vystavení jiným lyssavirům.
Viry vztekliny lze klasifikovat jako fixní (adaptované pasáží na zvířatech nebo v buněčné kultuře) nebo pouliční (divoký typ). Použití monoklonálních protilátek a genetického sekvenování k rozlišení pouličních virů vztekliny pomohlo identifikovat virové varianty pocházející z hlavních hostitelských rezervoárů po celém světě a naznačit pravděpodobné zdroje expozice člověka, i když v případě pacienta chyběla anamnéza definitivního kousnutí zvířetem.[ 8 ]
Patogeneze
Hlavním rezervoárem a zdrojem infekce u divokých zvířat jsou vlci, lišky, šakali, netopýři a u domácích zvířat psi a kočky, vzácně koně, skot, prasata, krysy atd. Přenos infekce z člověka na člověka je sice možný, ale extrémně vzácný. Jedná se o typickou zoonózu. Lidé se nakazí vzteklinou hlavně od psů.
Poté, co člověka uštkne nemocné zvíře, se virus v místě uštknutí rozmnoží ve svalové tkáni a poté, co dosáhne konců senzorických periferních nervů, se šíří centripetálně a dosahuje motorických neuronů. Doba, za kterou se virus dostane do pohybu a postižení mozku, závisí na místě uštknutí. V případě silného uštknutí hlavy a obličeje se virus může dostat do centrálního nervového systému za 15–20 dní a v případě drobného poškození kůže trupu a končetin a následně malé dávky patogenu se proces přesunu viru do centrálního nervového systému může zpozdit o několik měsíců nebo dokonce až o 1–1,5 roku. Po dosažení centrálního nervového systému se virus fixuje v tkáních mozku a míchy, zejména v neuronech prodloužené míchy, Ammonova rohu a báze mozkové. V míše jsou nejvíce postiženy zadní rohy. Z centrálního nervového systému se virus odstředivě podél nervových kmenů dostává do slinných žláz, kde se množí a vylučuje se slinami.
Koncepty v patogenezi vztekliny
RV má široké spektrum hostitelů a může infikovat téměř všechny savce. Ačkoli bylo hlášeno několik cest přenosu RV, k přirozené infekci nejčastěji dochází kousnutím. Kromě kousnutí může konzumace mrtvých těl nakažených RV podpořit infekci virem vztekliny u arktických lišek a kontakt RV se sliznicemi byl zjištěn jako další možná cesta přenosu.[ 9 ] Za některých neobvyklých okolností, jako je náhodné uvolnění RV ve formě aerosolu v laboratoři nebo RV ve formě aerosolu v jeskyních obývaných velkým množstvím netopýrů,[ 10 ] může dojít k přenosu aerosolu.
Zatím není jasné, zda se pouliční RV a kmeny RV adaptované na myši nebo adaptované na tkáňové kultury replikují v místě inokulace před vstupem do CNS. Zatímco experimentální intramuskulární infekce mladých křečků nebo mývalů pouličním RV odhalila replikaci RV v buňkách pruhovaného svalstva předtím, než virus napadl axony motorických neuronů přes neuromuskulární spojení,[ 11 ],[ 12 ] intramuskulární infekce myší myším adaptovaným CVS-24 RV ukázala, že RV migruje přímo do CNS bez předchozí replikace v místě inokulace.[ 13 ] Jakmile se RV dostane do zakončení nemyelinizovaných axonů, je retrográdně transportován do těla buňky.
Nedávné poznatky naznačují, že transport axonálními váčky může představovat klíčovou strategii pro pohyb virionů na dlouhé vzdálenosti v axonech.[ 14 ] Odhaduje se, že RV migruje v axonech rychlostí 3 mm/h.[ 15 ] Infekce se poté šíří řetězcem neuronů propojených synaptickými spojeními. Přesný mechanismus, který podporuje transsynaptické šíření, však stále není znám. Po infikování mozku se virus odstředivě šíří do periferního a autonomního nervového systému v mnoha periferních orgánech.[ 16 ] V poslední fázi infekčního cyklu RV migruje do slinných žláz; po replikaci v mukogenních acinárních buňkách se uvolňuje do slin a je připraven k přenosu na dalšího hostitele.[ 17 ]
Pokud jde o patologii vyvolanou virem vztekliny, byla v experimentálních modelech vztekliny u myší infikovaných fixním kmenem RV navržena apoptotická buněčná smrt jako potenciální patogenní mechanismus.[ 18 ] Patogenním mechanismem, který může přispívat k hluboké dysfunkci CNS charakteristické pro vzteklinu, může být narušená neuronální funkce. Bylo prokázáno, že genová exprese je v neuronech infikovaných RV výrazně snížena, což vede k obecnému potlačení syntézy proteinů,[ 19 ] a několik studií prokázalo narušenou neurotransmisi po infekci RV. Jiang prokázal, že vazba antagonisty acetylcholinového receptoru na infikované homogenáty mozku potkanů byla ve srovnání s kontrolami snížena.[ 20 ] V mozku potkanů infikovaných RV bylo také pozorováno zhoršené uvolňování a vazba serotoninu, neurotransmiteru zapojeného do řízení spánkového cyklu, vnímání bolesti a chování. [ 21 ], [ 22 ] Kromě ovlivnění neurotransmise může infekce pravé komory ovlivnit také iontové kanály. Infikované buňky myšího neuroblastomu vykazují sníženou funkční expresi napěťově řízených sodíkových kanálů, což může bránit akčním potenciálům a nakonec vést k funkčnímu poškození. [ 23 ]
Kromě absence závažných patologických lézí v CNS většina případů lidské vztekliny nevyvolává imunitní odpověď 7 až 10 dní po nástupu klinických příznaků. Tyto hluboké rozdíly mezi patogenezí vztekliny a patogenezí většiny ostatních virových nebo bakteriálních infekcí CNS jsou dále podpořeny skutečností, že imunosuprese je buď neúčinná, nebo má škodlivý vliv na výsledek vztekliny.[ 24 ] Nízká úroveň imunitní odpovědi často pozorovaná u obětí vztekliny je záhadná, protože ji nelze vysvětlit nízkou imunogenitou antigenů RV. Ve skutečnosti jsou RV G a nukleokapsidový protein při parenterálním podání silnými antigeny B a T buněk.[ 25 ] Možným vysvětlením nízkého stupně imunitní odpovědi proti RV u lidí nebo zvířat se vzteklinou může být to, že infekce CNS RV způsobuje imunosupresi [ 26 ] a bylo navrženo, že RV používá subverzivní strategii zahrnující prevenci apoptózy a ničení invazních T buněk.[ 27 ]
Oslabené kmeny RV, které byly adaptovány na neneuronální buňky, se významně liší od patogenních kmenů pouličního RV svou neuroinvazivností, která se týká jejich schopnosti napadat CNS z periferních míst. V tomto ohledu kmeny RV adaptované na tkáňové kultury buď postrádají, nebo mají pouze omezenou schopnost napadat CNS z periferních míst, zatímco kmeny pouličního RV nebo kmeny RV adaptované na myši, jako je CVS-24, jsou vysoce invazivní.[ 28 ] Mezi klíčové faktory podílející se na neuroinvazi RV patří virový příjem, axonální transport, transsynaptické šíření a rychlost replikace viru.
Až donedávna byly naše znalosti o patogenezi RV omezené a vycházely primárně z deskriptivních studií kmenů RV z ulice nebo z experimentálních infekcí s atenuovanými kmeny adaptovanými v laboratoři. Příchod technologie reverzní genetiky nám umožnil identifikovat virové elementy, které určují patogenní fenotyp RV, a lépe porozumět mechanismům zapojeným do patogeneze vztekliny.
Identifikace virových elementů řídících akvizici, šíření a replikaci viru vztekliny
- Virové prvky zapojené do zachycení viru
Infekce RV začíná připojením viru k předpokládanému buněčnému receptoru. Ačkoli bylo jako receptory RV navrženo několik molekul na povrchu membrány, včetně nikotinového acetylcholinového receptoru,[ 29 ] molekuly adheze nervových buněk[ 30 ] a nízkoafinitního neurotrofinového receptoru p75 NTR,[ 31 ] stále není jasné, zda tyto molekuly skutečně hrají roli v životním cyklu viru vztekliny. V této souvislosti bylo nedávno prokázáno, že interakce RV G–p75 NTR není pro infekci RV primárních neuronů nutná.[ 32 ] Po vazbě na receptor je RV internalizován prostřednictvím adsorpční nebo receptorem zprostředkované endocytózy.[ 33 ] Prostředí s nízkým pH v endosomálním kompartmentu poté indukuje konformační změny v RV G, které spouštějí fúzi virové membrány s endosomální membránou, čímž se uvolňuje RNP do cytoplazmy.[ 34 ] U virů hraje RV G klíčovou roli v virovém příjmu, s největší pravděpodobností prostřednictvím interakcí s předpokládanými buněčnými receptory, které usnadňují rychlé vychytávání. V tomto ohledu bylo prokázáno, že patogenita kmenů RV adaptovaných na tkáňové kultury (např. ERA, HEP a CVS-11) koreluje s přítomností determinantu umístěného v antigenním místě III G proteinu. [ 35 ] Mutace Arg → Gln v pozici 333 v tomto antigenním místě G proteinu ERA vedla k sedminásobnému zpoždění internalizace varianty Gln333 RV ve srovnání s variantou divokého typu. Mutace Asn194→Lys194 v RV G, která vysvětluje opětovný výskyt patogenního fenotypu, byla spojena s významným zkrácením doby internalizace.[ 36 ] Experimenty s chimérickými RV dále ukázaly, že doba potřebná k internalizaci RV virionů se významně zvýšila a patogenita se silně snížila po nahrazení genu G vysoce patogenního kmene SB RV, který byl odvozen z cDNA klonu stříbrem odvozeného kmene RV-18 asociovaného s netopýry,[ 37 ] genem vysoce atenuovaného kmene SN, který byl izolován z cDNA klonu vakcinačního kmene SAD B19 RV.[ 38 ] Tato data společně podporují myšlenku, že kinetika absorpce viru, která je funkcí RV G, je hlavním determinantem patogenity RV.
- Virové prvky zapojené do šíření a přenosu virů
Unikátní vlastností viru vztekliny je jeho schopnost šířit se z buňky do buňky. Pozorování, že varianta Gln333 ERA ztrácí in vitro aktivitu buněčné fúze závislou na pH [ 39 ] a vykazuje výrazně sníženou schopnost šířit se z buňky do buňky [ 40 ], naznačuje, že RV G hraje také klíčovou roli v šíření z buňky do buňky, a tedy i v přenosu viru, pravděpodobně prostřednictvím své fúziogenní aktivity. Tuto možnost dále podporuje zjištění, že rychlost šíření patogenního revertantního viru RV SPBNGAK je téměř dvakrát vyšší než rychlost stanovená u nepatogenní varianty SPBNGA. Je zajímavé, že mutace Asn 194 → Lys 194 v genu G SPBNGAK způsobila posun prahu pH pro membránovou fúzi k vyššímu pH, což podporuje hypotézu, že vyšší prah pH pro membránovou fúzi je spojen se zvýšeným šířením viru. [ 41 ]
Studie transneuronálních indikátorů infekce RV u potkanů [ 42 ] a makaků rhesus [ 43 ] ukázaly, že virus vztekliny migruje v axonech výhradně retrográdním směrem. Ačkoli se několik proteinů RV podílí na mechanismech neuronálního transportu, zdá se, že RV G hraje dominantní roli v transneuronálním šíření infekce RV. Například zatímco periferní infekce virem infekční anémie koní (EIAV) pseudotypovaným pomocí RV G vede k přenosu viru do míchy, stejný EIAV pseudotypovaný pomocí viru vezikulární stomatitidy G se nedostal do nervového systému. [ 44 ] Dále bylo zjištěno, že šíření viru mutantem ERA G Arg 333 → Gln 333 v CNS je silně sníženo ve srovnání s mutantem divokého typu, což dále naznačuje funkci intaktního RV G v transsynaptickém šíření. Nejpřesvědčivější důkaz o důležité roli RV G v transsynaptickém transportu však pochází z intrakraniální infekce myší rekombinantním G-deficitním virem RV, která ukázala, že infekce zůstala omezena na neurony v místě inokulace bez jakýchkoli důkazů o šíření do sekundárních neuronů.[ 45 ] Je však pravděpodobné, že kromě RV G hraje roli v šíření viru, a tedy i v transsynaptickém transportu, také RV M. V tomto ohledu bylo prokázáno, že šíření chimérické varianty RV SN-BMBG, která obsahuje M i G z vysoce patogenního SB, bylo významně vyšší než šíření chimérické varianty SN-BG nebo SN-BM, které obsahují G a M z SB, což naznačuje, že optimální interakce M s G může hrát důležitou roli v šíření viru z buňky do buňky.[ 46 ] Vzhledem k tomu, že RV M podporuje pučení viru,[ 47 ] je pravděpodobné, že efektivnější šíření chimérické varianty RV SN-BMBG je způsobeno optimálním pučením viru na postsynaptické membráně.
Nedávné studie ukázaly, že interakce mezi RV P a lehkým řetězcem dyneinu spojuje RV RNP s transportním systémem hostitelské buňky, čímž usnadňuje retrográdní axonální transport viru.[ 48 ],[ 49 ] Periferní infekce dospělých myší však ukázala, že delece vazebné domény LC8 RV P nezabraňuje vstupu viru do CNS, což naznačuje, že RV protein se přímo nepodílí na retrográdním axonálním šíření RV.[ 50 ]
- Virové elementy, které řídí replikaci viru
Na rozdíl od mnoha jiných virů, jako je virus chřipky, je patogenita RV nepřímo úměrná rychlosti syntézy virové RNA a produkci infekčních virových částic. Srovnání hladin virové mRNA a genomové RNA produkované různými chimérickými viry naznačuje, že transkripce a replikace virové RNA jsou regulovány mnoha faktory, včetně RV M, který byl identifikován jako trans-působící faktor, který zprostředkovává přechod z počátečních vysokých hladin syntézy mRNA na syntézu genomové RNA.[ 51 ] M ze všech rhabdovirů je navíc schopen zastavit expresi virových genů vazbou na RNP, což vede k tvorbě vysoce kondenzované struktury podobné páteři, která není schopna podporovat syntézu RNA.
Pro identifikaci dalších virových elementů, které kontrolují patogenitu regulací virové replikace, byly 5' terminální sekvence vysoce patogenního kmene SB postupně nahrazovány sekvencemi z vysoce atenuovaného vakcinačního kmene SN, což vedlo k rekombinantním virům SB2 (terminální sekvence [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G) a SB5 (TS + L + Ψ + G + M). Intramuskulární infekce rodičovskými viry SB a SN a chimérickými RV SB2, SB3, SB4 a SB5 vyvolala nejvyšší míru úmrtnosti u myší infikovaných SB a žádnou morbiditu ani mortalitu u myší infikovaných SN. Nahrazení TS, L a SB odpovídajícími elementy ze SN vedlo k mírnému snížení morbidity a mortality a další výměna G nebo G plus M silně snížila nebo zcela zrušila virovou patogenitu.
Fenotypová charakterizace těchto divokého typu a chimérických randomizovaných virů (RV) v tkáňové kultuře ukázala, že patogenita daného RV je nepřímo úměrná jeho schopnosti replikace v neuronálních buňkách. Ačkoli se SB replikoval na úrovních téměř 1000krát nižších než SN a nahrazení TS, L a v SB hladinami SN mělo malý vliv na kinetiku růstu viru, další nahrazení G nebo G plus M v SB odpovídajícími geny SN vedlo k 1log zvýšení produkce viru, což naznačuje, že kinetika replikace virové RNA i produkce virových částic jsou do značné míry řízeny proteinem G RV. Tento závěr podporují data získaná s variantami G RV, které se liší o jednu aminokyselinu ve svých G proteinech. Patogenní varianta viru vztekliny SPBNGAK 194 produkovala v NA buňkách titr viru, který byl o 1 log nižší než titr produkovaný nepatogenní variantou SPBNGAN 194, a analýza PCR v reálném čase ukázala, že rychlost transkripce a replikace virové RNA v NA buňkách infikovaných SPBNGAK byla 5krát a 10krát vyšší než v NA buňkách infikovaných SPBNGAK.[ 52 ] Další důkaz inverzní korelace mezi patogenitou a rychlostí syntézy virové RNA a produkcí virových částic poskytly myši infikované chimérickými rekombinantními viry, u kterých byly geny G a M atenuovaného kmene SN nahrazeny geny vysoce patogenního kmene SB. Tyto experimenty odhalily významný nárůst patogenity rodičovského kmene SN nesoucího RV G oproti patogennímu kmeni SB. Patogenita se dále zvýšila, když byly do SN zavedeny jak G, tak M z SB.
Substituce G nebo M nebo obou v proteinu SN odpovídajícími geny ze SB byla spojena s významným snížením rychlosti produkce virových částic a také rychlosti syntézy virové RNA. Tato data naznačují, že G i M hrají důležitou roli v patogenezi RV regulací virové replikace. Zjištění, že substituce G nebo G plus M v SN za G nebo G plus M ze SB vede ke střednímu až silnému snížení transkripce a replikace virové RNA, zatímco substituce samotného M v SN za M ze SB vede k silnému zvýšení transkripce a replikace virové RNA, naznačuje, že gen RV G má také důležitou regulační funkci v transkripci/replikaci virové RNA, ať už samostatně, nebo interakcí s proteinem M. Mechanismus, kterým gen RV G řídí syntézu virové RNA, není znám. Určité nukleotidové sekvence v genech RV G, jako například ty, které obsahují kodony pro Arg333 a Lys 194, byly identifikovány jako cíle pro buněčné miRNA. Bylo prokázáno, že rozpoznávání cíle buněčnými miRNA může vést k pozitivní nebo negativní regulaci virové replikace. [ 53 ] Substituce Arg 333 → Glu 333 nebo Lys 194 → Ser 194 v genové sekvenci RV G vedou k odstranění cílových sekvencí miRNA, což je následně spojeno s významným zvýšením rychlosti syntézy virové RNA [Faber M, Thomas Jefferson University, PA, USA, nepublikovaná data], což naznačuje, že miRNA hostitelských buněk hrají také důležitou roli v regulaci replikace RV, jak bylo prokázáno u jiných RNA virů, včetně viru vezikulární stomatitidy a HCV. [ 54 ], [ 55 ]
Regulace virové replikace se zdá být jedním z důležitých mechanismů zapojených do patogeneze RV. Aby se vyhnuly imunitní odpovědi a zachovaly integritu neuronální sítě, mohou patogenní kmeny RV, ale nikoli atenuované kmeny, regulovat svou rychlost růstu. Nižší rychlost replikace pravděpodobně prospívá patogenním kmenům RV tím, že zachovává neuronální strukturu, kterou tyto viry používají k dosažení CNS. Dalším vysvětlením nižší rychlosti replikace patogenního RV je, že aby se virus vyhnul včasné detekci imunitním systémem hostitele, udržuje si minimální hladiny exprese svých antigenů.
Vztah mezi expresí RV G, apoptózou a patogenitou
Je dobře známo, že kmeny viru vztekliny pouličních zvířat, které jsou výrazně patogennější než kmeny adaptované na tkáňové kultury, exprimují velmi omezené hladiny G a neindukují apoptózu až do pozdních fází infekčního cyklu, což naznačuje, že patogenita konkrétního virového kmene je nepřímo úměrná expresi RV G a schopnosti indukovat apoptózu.[ 56 ] Přímý důkaz korelace mezi úrovní exprese G a rozsahem apoptózy byl získán s rekombinantním RV SPBNGA-GA, který nesl dva identické geny G a nadměrně exprimoval RV G.[ 57 ] Morfologické studie neuronálních kultur infikovaných tímto rekombinantním RV ukázaly, že buněčná smrt byla významně zvýšena souběžně s nadměrnou expresí RV G a že apoptóza je hlavním mechanismem zapojeným do smrti zprostředkované RV G. Zejména pokles barvení F-aktinu po infekci SPBNGA-GA je v souladu s apoptózou indukovanou depolymerizací aktinových filament. Kromě toho byl počet TUNEL-pozitivních jader v neuronech infikovaných SPBNGA-GA významně zvýšen ve srovnání s neinfikovanými a SPBNGA-infikovanými neurony. Mechanismus, kterým gen RV G zprostředkovává proces apoptotické signalizace, však zůstává do značné míry neznámý. Bylo navrženo, že exprese RV G nad určitou prahovou hodnotou vážně narušuje buněčnou membránu. Je vysoce pravděpodobné, že apoptotické buňky nejsou v CNS rychle odstraněny, a proto podléhají sekundární nekróze. [ 58 ] Na druhou stranu, infekce RV a zejména nadměrná exprese proteinu RV G může vést k pyroptóze, dráze buněčné smrti podobné apoptóze, která na rozdíl od apoptózy zahrnuje aktivaci kaspázy 1, a tím vede k nekróze. [ 59 ] Stupeň nekrózy nebo pyroptózy vyvolané infekcí RV pravděpodobně hraje klíčovou roli v indukci antivirové imunity. Zatímco apoptotické buňky si zachovávají integritu své membrány a nestimulují vrozenou imunitní odpověď, nekrotické buňky se stávají permeabilizovanými a vylučují endogenní adjuvans, která mohou spustit robustní vrozenou imunitní odpověď. [ 60 ]
Vzhledem k tomu, že úroveň apoptózy/nekrózy koreluje s imunogenicitou RV, bylo navrženo, že imunostimulační účinek apoptotických/nekrotických buněk s největší pravděpodobností přispívá k vytvoření ochranné imunitní odpovědi. Regulace exprese RV G je proto s největší pravděpodobností důležitým faktorem v patogenezi vztekliny, protože poskytuje prostředky pro přežití a šíření patogenních variant RV v nervovém systému, aniž by způsobovala zjevné poškození neuronů, a vyvolává ochrannou imunitní odpověď, která by zabránila infekci.
Exprese RV G může být regulována na úrovni syntézy RNA, na posttranslační úrovni nebo na obou. Bylo prokázáno, že hladiny RV G exprimovaného různými chimérickými variantami RV se odrážejí v rychlosti syntézy virové RNA, což naznačuje, že rozdílná regulace exprese RV G těmito variantami vyplývá z rozdílů v rychlosti transkripce virové mRNA. Stejně jako u rychlosti transkripce virové RNA, množství RV G exprimovaného těmito variantami nepřímo koreluje s virovou patogenitou. Na druhou stranu infekce primárních neuronálních kultur méně patogenní variantou RV CVS-B2c vedla ke čtyřnásobně vyšším hladinám G proteinu než infekce vysoce patogenní variantou CVS-N2c, a to i přes syntézu srovnatelných hladin G mRNA u obou infekcí. Experimenty Pulse-chase ukázaly, že vyšší hladiny G proteinu v neuronech infikovaných CVS-B2c byly z velké části výsledkem nižší rychlosti degradace G proteinu CVS-B2c ve srovnání s G proteinem CVS-N2c. Mechanismus, který vede k rychlejší proteolytické degradaci G proteinu CVS-N2c, však stále není objasněn.
Symptomy vzteklina
Inkubační doba vztekliny je v průměru 30–90 dní. V případě masivní infekce rozsáhlými ranami na hlavě a obličeji se může zkrátit na 12 dní. Ve vzácných případech může inkubační doba trvat 1 rok nebo déle.
Existuje striktně postupné střídání tří období onemocnění: prodromální, excitační, paralýza.
Prodromální období začíná výskytem bolestivé nebo tahové bolesti v místě kousnutí a také bolesti podél nervů. V oblasti jizvy se může objevit pocit pálení, svědění, někdy zarudnutí a otok. Pacient pociťuje celkovou malátnost, bolest hlavy, nevolnost. Zaznamenává se zvracení, zvýšení tělesné teploty na 37,5-38 °C a příznaky progresivní duševní poruchy: zvýšená reflexní dráždivost, nevysvětlitelný pocit úzkosti, strachu, melancholie. Pacient je často depresivní, inhibovaný, uzavřený do sebe, odmítá jíst, špatně spí, stěžuje si na pochmurné myšlenky, děsivé sny. Prodromální období trvá 2-3 dny, někdy se prodlužuje až na 7 dní. Na konci tohoto období se mohou objevit záchvaty úzkosti s krátkodobými dýchacími potížemi, pocitem tísně na hrudi, doprovázené tachykardií a zvýšenou dechovou frekvencí.
Období vzrušení je poznamenáno výskytem hydrofobie: při pokusu o pití a poté při pohledu na vodu nebo jejím připomenutí pacient zažívá křečovitý křeč hltanu a hrtanu, během kterého s výkřikem odhodí hrnek s vodou, třesoucí se ruce předkloní, zakloní hlavu a tělo. Krk je natažený, bolestivá grimasa zkresluje obličej, který v důsledku křeče dýchacích svalů zmodraje. Oči vypoulí, vyjadřují strach, prosí o pomoc, zornice jsou rozšířené, nádech je obtížný. Na vrcholu záchvatu je možná srdeční a dechová zástava. Záchvat trvá několik sekund, po kterých se stav pacienta zdánlivě zlepšuje. Následně se mohou objevit záchvaty křečí svalů hrtanu a hltanu i z pohybu vzduchu (aerofobie), jasného světla (fotofobie) nebo hlasitého slova (akustikofobie). Záchvaty jsou doprovázeny psychomotorickým neklidem, během kterého se pacient chová jako „šílenec“. Vědomí je během záchvatu zamlžené, ale v interiktálním období se vyjasní. V období agitace se u pacientů v důsledku zvýšeného tonusu sympatického nervového systému objevuje prudké zvýšení slinění (sialorea) s neschopností polykat sliny v důsledku křeče faryngeálních svalů. Pacient stříká sliny. U některých pacientů se mohou objevit známky meningismu a dokonce i opisthotonu, časté jsou křeče. V tomto případě se mozkomíšní mok nemusí měnit, ale u některých pacientů se může zvýšit koncentrace bílkovin a počet buněk se může zvýšit v důsledku lymfocytů.
Bez adekvátní léčby se stupňují známky dehydratace, rysy obličeje se zostřují a tělesná hmotnost klesá. Tělesná teplota stoupá na vysoké hodnoty. Možné jsou křeče. Délka fáze excitace je asi 2-3 dny, vzácně 4-5 dní. K úmrtí obvykle dochází během jednoho z atak. Vzácně pacient přežije do třetí fáze onemocnění.
Během období paralýzy se pacient uklidní. Záchvaty hydrofobie ustávají, pacient může pít a polykat jídlo, vědomí je jasné. Navzdory zdánlivé pohodě se však brzy objevuje letargie, apatie, deprese, paralýza končetin, pánevní poruchy a paralýza hlavových nervů. Tělesná teplota stoupá na 42–43 °C, klesá arteriální tlak a do konce prvního dne nastává smrt v důsledku paralýzy kardiovaskulárního a dýchacího centra.
V periferní krvi se pozoruje neutrofilní leukocytóza, zvýšený hemoglobin, erytrocyty a hematokrit.
Co tě trápí?
Formuláře
Klinicky se rozlišují typické a atypické formy. Atypické formy zahrnují všechny případy bez excitace a hydrofobie. Atypické formy zahrnují bulbární, cerebelární, meningoencefalitické atd.
Diagnostika vzteklina
Detekce antigenu vztekliny, protilátek, virové RNA nebo izolace viru umožňuje diagnostiku vztekliny. Protože u pacienta se vzteklinou může být jakýkoli individuální test negativní, jsou někdy nutné sériové odběry séra pro detekci protilátek proti vzteklině, vzorky slin pro virovou kultivaci a biopsie kůže pro přímé imunofluorescenční testování virového antigenu, zejména při silném podezření na vzteklinu.
Jednou z nejrychlejších metod pro diagnostiku vztekliny u lidí před smrtí je provedení přímého imunofluorescenčního testu na biopsii kůže z šíje k detekci antigenu vztekliny. Přímý imunofluorescenční test je nejcitlivější a nejspecifičtější metodou pro detekci antigenu vztekliny v kůži a dalších čerstvých tkáních (např. biopsie mozku), i když výsledky mohou být občas v rané fázi onemocnění negativní. Pokud není čerstvá tkáň k dispozici, může enzymatické štěpení fixovaných tkání zvýšit reaktivitu imunofluorescenčního testu; citlivost však může být nepřijatelně nízká.
Diagnózu lze také stanovit, pokud je virus izolován ze slin po inokulaci buněk neuroblastomu nebo laboratorních hlodavců; to je obvykle nejúčinnější během prvních 2–3 týdnů onemocnění. Diagnostická je také detekce protilátek neutralizujících virus vztekliny, obvykle prováděná rychlým fluorescenčním fokusovým inhibičním testem (RFFIT), v séru neočkovaných jedinců. Přítomnost protilátek v mozkomíšním moku potvrzuje diagnózu, ale mohou se objevit o 2–3 dny později než sérové protilátky, a proto mohou být v raných stádiích onemocnění méně užitečné. Zatímco sérologická odpověď po očkování je obecně nerozeznatelná od sérologické odpovědi vyvolané onemocněním, očkování obvykle neprodukuje protilátky proti mozkomíšnímu moku.
Za posledních 25 let bylo dobře zdokumentováno pouze sedm případů „uzdravení“ ze vztekliny. Ačkoli virus vztekliny nebyl u žádného z pacientů izolován, vysoké titry protilátek neutralizujících vzteklinu ve vzorcích séra a přítomnost neutralizačních protilátek v mozkomíšním moku diagnózu silně podporovaly.
Co je třeba zkoumat?
Jaké testy jsou potřeba?
Diferenciální diagnostika
Diagnóza vztekliny u lidí se obvykle stanoví na základě epidemiologických a klinických údajů a potvrdí se laboratorně. Diagnóza je jednoduchá, pokud je v anamnéze pokousání zvířetem a projevilo se celé spektrum symptomů a projevů. V opačném případě je před provedením specifických laboratorních testů nutné pečlivé, ale rychlé vyhodnocení epidemiologických a klinických rysů méně typických případů. Každý pacient s neurologickými příznaky nebo symptomy nebo nevysvětlitelnou encefalitidou by měl být dotázán na možnost kontaktu se zvířaty v oblastech endemických pro vzteklinu v zemi bydliště nebo mimo ni. Neexistence podezření na vzteklinu u několika nedávných úmrtí lidí ve Spojených státech mohla být způsobena nedostatečnou pečlivou anamnézou expozice.
Na začátku onemocnění může vzteklina napodobovat mnoho infekčních i neinfekčních onemocnění. Mnoho dalších encefalitid, například ty způsobené herpesviry a arboviry, se vzteklině podobá. Vzteklinu mohou napodobovat i další infekční onemocnění, jako je tetanus, mozková malárie, rickettsióza a tyfus. Mezi paralytická infekční onemocnění, která lze se vzteklinou zaměnit, patří poliomyelitida, botulismus a herpes simian B encefalitida.
Mezi neinfekční onemocnění, která lze zaměnit se vzteklinou, patří řada neurologických syndromů, zejména akutní zánětlivá polyneuropatie (Guillain-Barréův syndrom), dále alergická postvakcinační encefalomyelitida sekundární k očkování proti vzteklině v nervové tkáni, otrava nebo intoxikace drogami, abstinenční příznaky z alkoholu, akutní porfyrie a hysterie způsobená vzteklinou. Guillain-Barréův syndrom lze zaměnit za paralytickou vzteklinu a naopak.
Kdo kontaktovat?
Léčba vzteklina
Léčba vztekliny nebyla vyvinuta. Podávání velkých dávek specifického imunoglobulinu proti vzteklině a leukocytárního interferonu je neúčinné. K úlevě od utrpení pacienta se podává symptomatická léčba. Za tímto účelem je pacient umístěn na samostatné oddělení nebo box, je vytvořen ochranný režim, který omezuje vliv vnějšího prostředí (snížený hluk, jasné světlo, proudění vzduchu). Pro snížení dráždivosti centrálního nervového systému se předepisují léky na spaní, antikonvulziva a léky proti bolesti. Normalizuje se vodní bilance.
V paralytickém stádiu se předepisují léky stimulující aktivitu kardiovaskulárního a dýchacího systému. Doporučuje se hyperbarická oxygenace, mozková hypotermie, řízené mechanické dýchání s úplnou kurarizací pacienta. Všechny léčebné metody jsou však prakticky neúčinné. V nejlepším případě je možné prodloužit život pacienta o několik měsíců. Nepříznivý výsledek je předurčen závažností poškození mozkového kmene se zničením životně důležitých center.
Prevence
Vývoj první vakcíny proti vzteklině Pasteurem v roce 1885 zahájil éru mnohem účinnější kontroly vztekliny. Dnes, navzdory téměř 100% úmrtnosti lidí na vzteklinu, lze tomuto onemocnění zcela předejít pre- a/nebo postexpoziční vakcinací. Zatímco Pasteur a jeho kolegové zahájili vakcinaci soukromých psů v Paříži, první hromadná vakcinace psů byla provedena na začátku 20. let 20. století v Japonsku, což znamenalo první velký národní program kontroly vztekliny. Orální vakcinace divokých zvířat, poprvé vyvinutá v 70. letech 20. století, od té doby opakovaně prokázala účinnou kontrolu onemocnění u hlavních suchozemských hostitelů, jako jsou lišky, mývalové a skunkové.[ 68 ] Dlouhodobá vakcinace proti vzteklině u populací rezervoárových zvířat s mírou pokrytí 70 % nebo vyšší nakonec eliminuje RABV z rezervoárových druhů a zabrání šíření viru na náhodné hostitele.[ 69 ]
Fylogenetická data naznačují, že lyssaviry infikovaly netopýry dlouho předtím, než infikovaly suchozemské savce, a většina lyssavirů, včetně RABV, stále cirkuluje u různých druhů netopýrů po celém světě.[ 70 ] Účinné metody prevence přenosu RABV mezi netopýry však zůstávají nejasné, což v současné době vylučuje možnost úplné eradikace vztekliny. Avšak i po expozici RABV kousnutím savcem nakaženým vzteklinou může bezpečná a účinná postexpoziční profylaxe (PEP, včetně čištění ran, imunoglobulinu proti vzteklině a očkování proti vzteklině) chránit lidi před infekcí vzteklinou, pokud je léčba provedena včas a v souladu s doporučeními Světové zdravotnické organizace (WHO).
Tyto dvě metody prevence lidských úmrtí – jedna založená na očkování exponovaných osob a druhá založená na očkování dostatečného počtu psů k přerušení cyklu přenosu u zdroje – jsou stavebními kameny přístupu „jedno zdraví“ k prevenci a kontrole vztekliny u psů. Tyto dva různé způsoby prevence lidských úmrtí byly zvažovány jako samostatné alternativy: strategie A, založená na poskytování PEP lidem, a strategie B, založená na očkování psů; nebo jako součásti kombinované strategie A + B v analýze pravděpodobných nákladů alternativních strategií.[ 71 ]
Země jako Thajsko dosáhly obrovského úspěchu v prevenci lidských úmrtí pomocí PEP, ale také zjistily rostoucí poptávku a související náklady spojené s používáním samotné PEP. [ 72 ] Například ve srovnání se situací v roce 1991 potřebovalo PEP v roce 2003 čtyřikrát více lidí (více než 400 000). Nedávné údaje ukazují, že Čínská lidová republika, která očkuje 15 milionů lidí ročně po potenciální expozici vzteklině, utratí ročně přibližně 650 milionů USD pouze za PEP. [ 73 ]
Mnohem udržitelnějším přístupem je zabránit šíření infekce u zdroje, tedy v populaci zvířat, a zároveň v případě potřeby zvýšit přístup k PEP pro exponované lidské pacienty. Tam, kde existuje politická vůle a dostatečné financování ke kontrole vztekliny u psů, lze a již bylo eliminováno úmrtí. Rozšířené používání očkování psů vedlo k eliminaci vztekliny u psů v několika zemích, včetně Malajsie v roce 1954, [ 74 ] Japonska v roce 1956, Tchaj-wanu v roce 1961, Singapuru a zejména v celé západní Evropě (přehled v Rupprecht et al., King et al. a Gongal a Wright). [ 75 ]
Использованная литература


 [
[