Experimentální modely osteoartrózy
Naposledy posuzováno: 23.04.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Chrupavka je vysoce specializovaná tkáň obsahující pouze jeden typ buněk (chondrocyty), charakterizovaný nepřítomností krve a lymfatických cév. Výživa chrupavky se provádí hlavně absorpcí ze synoviální tekutiny. Metabolismus chondrocytů je regulován množstvím rozpustných faktorů produkovaných lokálně chondrocyty a okolními tkáněmi. Funkce chondrocytů také závisí na složení extracelulárního média (napětí kyslíku, koncentrace iontů, pH atd.), Složení VCM, interakce buněk a matric, fyzikální signály. Hlavním úkolem experimentálního modelování je vytvoření kultur v extracelulárním prostředí bez změny fenotypu zralých buněk. Druhým úkolem je vytvořit kultury pro studium předčasné, zpožděné, krátké nebo dlouhodobé reakce chondrocytů na chemické a / nebo fyzické signály. Studie in vitro také poskytují příležitost ke studiu chování chondrocytů u osteoartrózy. Třetím úkolem je vývoj ko-léčivých systémů, které umožňují studovat interakce různých tkání v kloubu. Čtvrtým úkolem je příprava chrupavkových implantátů pro následnou transplantaci. A konečně pátým úkolem je studium růstových faktorů, cytokinů nebo terapeutických činidel, které jsou schopné stimulovat opravu a / nebo inhibovat resorpci chrupavky.
Během posledních desetiletí byly vytvořeny různé modely buněčných kultur kloubní chrupavky, včetně monovrstvových kultur, suspendovaných kultur, chondronových kultur, explantátů, kokultiv, nesmrtelných buněčných kultur. Každá kultura má své výhody a nevýhody a každá z nich je vhodná pro studium jednoho konkrétního aspektu metabolismu chondrocytů. Tak jsou chrupavčité explantáty vynikajícím modelem pro studium obratu matricových prvků, které vyžadují autentické buněčné povrchové receptory a normální interakce buněk-matrice a matrice-buňky. Současně se doporučuje provést studium ložisek v matrici nebo mechanismy regulace metabolismu chondrocytů na kultuře izolovaných buněk. Monolitická kultura s nízkou hustotou je nezbytná pro studium procesu buněčné diferenciace. Kultura suspendovaná v přírodní nebo syntetické matrici je model pro analýzu adaptivní odezvy chondrocytů na mechanické namáhání.
Chondrocytové kultury
Při výběru tkáně chrupavky pro in vitro studie je třeba vzít v úvahu několik důležitých bodů. Složení matrice a metabolické aktivity chondrocytů se liší v různých kloubech, a ten závisí také na hloubce umístění v chondrocytů tkáni. Tato data byla získána v několika experimentech, ve kterých byly studovány izolované subpopulace chondrocytů z chrupavkových zón různých hloubek. Byla zjištěna řada morfologických a biochemických rozdílů mezi kultivovanými chondrocyty umístěnými v povrchu a hlubokými vrstvami kloubní chrupavky. Povrchové buňky syntetizují vzácnou, ochuzenou proteoglykanovou vláknitou matrici, zatímco hlubší buňky produkují matrici, která je bohatá na fibrily a proteoglykany. Navíc povrchové buňky produkují relativně více malých neagregovaných proteoglykanů a kyseliny hyaluronové a relativně méně agreganu a keratan-sulfátu než hlubokoji umístěné chondrocyty. Další důležitou charakteristikou metabolismu chondrocytů izolovaných z chrupavkových zón různých hloubek je odezva na exogenní podněty. Podle M. Aydelotte a spoluautorů byly býčkové chondrocyty z povrchové zóny chrupavky citlivější na IL-1 než buňky hluboké zóny.
Chování buněk také závisí na umístění tkáně. Chondrocyty chrupavky a ušní hrany, pořízených ze stejného zvířete, které reagují různě na růstové faktory, jako je fibroblastový růstový faktor (FGF) a TGF-beta. FGF zvýšil začlenění thymidinu, prolinu a leucinu do chondrocytové kultury žebra, ale ne ucha. TGF-P zvyšuje inkorporaci thymidinu do chrupavky chondrocytů žebra a ucha, ale neměl žádný účinek na inkorporaci thymidinu do chondrocytů a prolinu ucha. Buněčné buňky chrupavky získané z oblastí s největším zatížením se liší od míst s malým zatížením chrupavky. Například, zralých chondrocytů z chrupavky kolenního kloubu z centrální oblasti ovce kloubní tibiální povrch kostí se nevztahuje menisku, který nese největší zatížení in vivo, menší syntetizován agrekanu, dekorinu ale větší než buněk oblastech, kterých se menisku. Autoři také zdůrazňují důležitost používání chrupavky z identických kloubních zón při zkoumání syntetické funkce kloubů.
Metabolismus chondrocytů a jejich reakce na regulační faktory také významně závisí na věku dárce, vývoji jeho kostry a stavu kloubů, ze kterých jsou buňky odebírány. U lidských chondrocytů je pozorován významný pokles věku proliferační odpovědi. Největší pokles zaznamenaly dárci ve věku 40-50 let a více než 60 let. Navíc závažnost proliferační odpovědi na růstové faktory (např. FGF a TGF-beta) klesá během stárnutí. Vedle kvantitativních změn v proliferaci chondrocytů dochází také k kvalitativním změnám. Mladé dárcovské buňky (ve věku 10-20 let) lépe reagují na růstový faktor odvozený od trombocytů (PDGF) než na TGF-beta, zatímco opak je pozorován u dospělých donorových buněk. K vysvětlení věkových závislých změn v syntetické funkci chondrocytů a jejich reakce na účinek růstových faktorů se používá několik mechanismů. Mezi nimi pokles počtu a afinity povrchových buněčných receptorů, změna syntézy a bioaktivity růstových faktorů a cytokinů, modifikace signálů postreceptoru.
Patologický stav kloubů také mění morfologii a metabolickou aktivitu chondrocytů. Takže J. Kouri a spoluautoři (1996) identifikovali tři subpopulace chondrocytů v chrupavce s osteoartritidou. Chondrocyty z povrchového a horního středu chrupavky tvoří klastry a syntetizují více proteoglykanů a kolagenu. TGF-beta, a růstový faktor podobný inzulínu (IGF), může stimulovat syntézu proteoglykanů chondrocyty a částečně neutralizovat účinky IL-1 a TNF-a. Chrupavky explantáty byly postiženy s osteoartritidou a chondrocyty izolované z chrupavky u pacientů s osteoartritidou, jsou citlivější na stimulaci TGF-beta než zdraví chondrocyty chrupavky. Tyto rozdíly jsou s největší pravděpodobností spojeny s fenotypovými změnami chondrocytů v horních vrstvách kloubní chrupavky.
Izolace jednotlivých chondrocytů je dosažena sekvenční léčbou proteolytickými enzymy ECM. Po uvolnění z ECM jsou izolované buňky ideálně vhodné pro studium syntézy de novo matricových složek . Někteří autoři používají pouze klostridium kolagenázu, jiní předinkubují chrupavku trypsinem, pronasou, DNázou a / nebo hyaluronidázou. Počet izolovaných buněk závisí na použitých enzymech. Tedy, při zpracování jednoho z 1 g kolagenázy tkáně může být získána 1,4T0 6 chondrocyty, zatímco při použití pronasa, hyaluronidasy a kolagenázu - 4,3-10 6. Při zpracování s kolagenázou, aggrekan, proteiny, IL-6, IL-8 zůstávají v buněčné kultuře mnohem víc než v případě postupného ošetření různými enzymy. Existuje několik vysvětlení těchto rozdílů mezi dvěma buněčnými kulturami:
- Buněčné receptory poškozené nebo deprese působením enzymů, TGF-beta inhibuje syntézu DNA proteoglykanů v nově izolovaných chondrocytů (den 1), zatímco DNA a proteoglykanu syntézy chondrocytů kultivovaných v monovrstvě (7 dní) stimulované TGF-beta. Avšak k opětovnému vystavení těchto membránových komponent je nutná dostatečná doba před začátkem experimentu.
- Exogenní proteázy mohou přerušit interakce buněk a matrice zprostředkované integriny. Rodina integrinů podporuje vazbu chondrocytů na molekuly VKM (Shakibaei M. A kol., 1997) .Toto ruptura může ovlivnit expresi matricových genů.
- Zbytky matricových složek mohou regulovat syntetickou funkci chondrocytů. Integriny jsou schopny rozpoznat degradační produkty ECM, čímž hrají důležitou roli při opravě tkání po expozici proteolytickým enzymům. T. Larsson a spoluautoři (1989) uvedli, že přidání intaktních nebo fragmentovaných pro-theoglykanů k buněčné kultuře stimuluje syntézu proteinů a proteoglykanů. Nicméně, vysoké hladiny kyseliny hyaluronové způsobuje významné snížení v začlenění síranu proteoglykanu syntézy chondrocytů chondrocyty kuřecích embryí zralý prasečí a krysí chondrosarkom buňky. Kromě toho hyaluronová kyselina - inhibitor proteoglykanu uvolňování z buněk i v přítomnosti IL-lb, TNF-a, FGF, což ukazuje, že působí proti první biologickou aktivitu růstových faktorů a cytokinů. Přesný mechanismus, na kterém působí působení kyseliny hyaluronové, zůstává nejasný; Je známo, že chondrocyty obsahují receptor pro kyselinu hyaluronovou, spojenou s aktinovými vlákny cytosolu. Vazba kyseliny hyaluronové na receptor stimuluje fosforylaci proteinů. Tato data tedy ukazují, metabolické modulační funkce přirozených chondrocytů nebo fragmentované molekuly matricových proteinů aktivací buněčné membránové receptory.
- Rychlá stimulace syntézy matrice chondrocytů enzymových proteinů může být v důsledku změn tvaru chondrocytů a / nebo reorganizaci cytoskeletu.
- Některé cytokiny (např. IL-8) a růstové faktory (např. IGF-1, TGF-P) jsou fixovány v ECM. Nejznámějším příkladem je vazba TGF-beta s dekorem, což vede ke snížení schopnosti buněk vyvolat buněčný růst vaječníků u čínských křečků. Údaje, že obsah dekorace chrupavky se zvyšuje s věkem, naznačují pokles biologické dostupnosti TGF-beta při stárnutí. Růstové faktory a cytokiny se mohou uvolňovat z matricových zbytků během kultivace a potom modulovat funkci chondrocytů.
Monovrstvá kultura chondrocytů
Diferencované fenotypu chondrocytů v první řadě vyznačuje tím, syntézy kolagenu typu II a proteoglykany, tkáňově specifické a nízká mitotická aktivita. Existují důkazy, že dlouhodobé kultivaci buněk v monovrstvě, a po několika opakovaných pasážích buněk, chondrocytů ztrácejí svůj tvar koule, stane se podlouhlý, fibroblastů podobný tvar. S takovým fibroblastů metaplazie syntetické funkce je také modifikované buňky, charakterizované progresivním snížením syntézy kolagenu II, IX a XI typy a zlepšená syntéza kolagenu I, III a Utipov. Malé neagregované proteoglykany jsou syntetizovány funkčním agreganem. Synthetzatepsin B a L je extrémně nízký v diferencovaných buňkách, ale v procesu ztráty diferenciace se zvyšuje. Kolagenasa-1 je exprimována v diferencovaných chondrocytech s prodlouženou kultivací, její exprese se snižuje, zatímco produkce tkáňových inhibitorů metaloproteináz (TIMP) se zvyšuje.
Diferencované chondrocyty re-exprimují kolagen diferencovaného fenotypu, když jsou přeneseny z monovrstvé kultury do suspendované kultury. Proces diferenciace pravděpodobně souvisí s tvarem buněk. Tato vlastnost je pravidelně používána výzkumníky, kteří studují vadné transplantáty s autologními chondrocyty. Malý počet buněk získaných z materiálu biopsie může být násoben v monovrstvé kultuře a poté znovu umístěn do trojrozměrné matrice před transplantací. Re-exprese specifického fenotypu dediferencovanými chondrocyty přenesenými do agarózové kultury může být stimulována TGF-p, komplexem ossein-hydroxyapatit a kyselinou askorbovou.
V reakci na účinek růstových faktorů a cytokinů se chondrocyty během procesu diferenciace modifikují. Buněčná odpověď na cytokiny a růstové faktory se liší mezi nediferencovanými a diferencovanými chondrocyty. IL-1 stimuluje proliferaci fibroblastů, zatímco růst nediferencovaných chondrocytů je inhibován IL-1. Syntéza DNA je stimulována IGF-1 v prodloužených, ale ne zploštělých chondrocytech. V diferencovaných chondrocytech jsou stimulační účinky IL-1 β a TNF-α na prokolagenázové produkty výraznější než u nediferencovaných.
Pěstování chondrocytů
Kultivace chondrocytů v suspenzi v kapalném médiu nebo v přírodní nebo syntetické trojrozměrné matrici stabilizuje fenotyp chondrocytu. Buňky si zachovávají svůj sférický tvar, syntetizují tkáňově specifické proteiny. Vážená chondrocytová kultura se obvykle doporučuje pro studium vzniku nové perikulární matrice. Chondrocytové kultury v syntetických nebo přirozených absorpčních polymerech se používají k implantaci buněk do defektů chrupavky ke stimulaci regenerace chrupavkové tkáně kloubu. Syntetické nebo přírodní prostředí pro implantovatelné buňky musí splňovat řadu požadavků:
- Implantáty by měly mít porézní strukturu pro adhezi a růst buněk,
- ani samotný polymer ani produkty jeho rozkladu by neměly způsobovat zánět nebo toxické reakce během implantace in vivo,
- nosič transplantátu by měl být schopen se vázat na sousední chrupavku nebo subchondrální kost,
- musí být přirozená nebo syntetická matrice schopna absorpce, její degradace musí být vyvážena regenerací tkáně,
- Pro usnadnění opravy chrupavky by chemická struktura a maticová struktura matrice měla pomáhat udržovat buněčný fenotyp vložený do chondrocytů a syntézu tkáňově specifických proteinů,
- během implantace in vivo je nutné zkoumat mechanické vlastnosti syntetické nebo přírodní matrice.
Suspenze chondrocytů v kapalné fázi
Přichycení buněk na plastové nádoby, ve které je kultivace chondrocytů mohou být zabráněno jejich stěny potáhnou roztokem methylcelulózy, agaróza, hydrogel (poly-2-hydroxyethylmethakrylát) nebo směs kolagenu-agarózy. Za těchto podmínek tvoří chondrocyty klastry a syntetizují hlavně kolageny specifické pro agrekan a tkáň (typy II, IX, XI). Obvykle jsou nalezeny dva typy buněk. Buňky umístěné ve středu zachovávají sférický tvar obklopený dobře vyvinutým ECM, což potvrzují histochemické a ultrastrukturální studie. Na obvodu chondrocyty mají diskoidní obrysy, jsou obklopeny vzácnou ECM; O funkčních vlastnostech těchto buněk je známo jen málo.
Je možné kultivovat chondrocyty na mikronosičů v suspenzi; jako mikronosiče s použitím dextranové perličky (tsitodeks), kolagen potažené dextranové perličky (tsitodeks III), besporovye mikrokuličky jsou kolagen typu I (tsellagen). Při těchto kultivačních podmínkách se chondrocyty připevňují k povrchu mikronosičů, zachovávají sférický tvar a vytvářejí materiál podobný matrici. Navíc použití kolagenu podporuje proliferaci chondrocytů a reexpresi normálního fenotypu. Proto může být kultivace chondrocytů na mikrokuličkách kolagenu použita k obnovení buněčného fenotypu před transplantací.
Další způsob kultivace chondrocytů suspendované v kapalném médiu je ve formě jejich pěstování hustých korálky, skládající se z buněk (0,5 až 1 * 10 b ) získané centrifugací. Tyto chondrocyty jsou schopné produkovat matrici obsahující velké množství proteoglykanů, II typu kolagenu, ale ne kolagen typu I, který byl potvrzen histologických, imunohistochemických a kvantitativních metod.
Suspenze chondrocytů v přirozeném ECM
Chondrocyty mohou být kultivovány v suspenzi v trojrozměrné matrice (měkkém agaru, agarózy, volání geny gel nebo houba, kyselina hyaluronová, fibrinové lepidlo, alginátové perličky).
Kultivované agarózové chondrocyty si zachovají svůj normální fenotyp a syntetizují kolagen typu II a tkáňově specifické agregáty nové agregáty. Když se kultivuje v agaróze, proteoglykany syntetizované buňkami se uvolňují do média po dobu 50 dnů. Pro srovnání - v monovrstvé kultuře je buněčná fáze přeplněna glykosaminoglykany již v prvních 5-6 dnech kultivace; když se kultivuje v médiu po zesílení syntézy a uvolňování glykosaminoglykanů, časově závislé snížení glykosaminoglykanů nastává v prvních 8 až 10 dnech. Nicméně chování chondrocytů během jejich kultivace v agaróze se liší od chování v podmínkách in vivo. V agaróze obsahuje velké množství syntetizovaných Aggreganových agregátů menší a menší molekuly než in vivo. TGF-P stimuluje syntézu proteoglykanů v explantátu, ale snižuje syntézu agreganu v agaróze.
Alginát je lineární polysacharid odvozený od hnědých mořských řas. V přítomnosti dvojmocných kationtů, jako jsou Ca 2+ ionty, se tento polymer stává gelem. Každý chondrocytů chycen v alginátu, které je obklopeno matricí negativně nabitých polysacharidů, póry, které jsou srovnatelné s těmi, hyalinní chrupavky. Matice, která je vytvořena v chondrocyty alginátových partikulí, skládající se ze dvou částí - tenká vrstva buněk asociované matice odpovídající pericelulárních a územní matrice kloubní chrupavky a vzdálenější matice územími ekvivalent v nativním tkáni. Na 30. Den kultivace, relativní a absolutní objem obsazený buňkami, a každý ze dvou oddělení v alginátové perličky, je téměř zcela identické s nativní chrupavce. U téměř 30 dní chondrocyty zachovat jejich kulový tvar a produkují agrekan, hydrodynamické vlastnosti, které jsou podobné těm, které agrekanu molekul v matrici kloubní chrupavky a molekuly kolagenu II, IX a XI typy. Ve stejné době, jako jiných kultur, suspenzí, alginátové kuličky na povrchu zploštělých buněk jsou přítomny, které generují malé množství kolagenu typu I molekuly, vypouštěny přímo do životního prostředí a nezačleněné do videorekordéru. U alginátových perliček je pozorována mírná proliferace chondrocytů. Po 8 měsících kultivace v alginátového gelu zralých chondrocytů neztrácejí metabolickou aktivitu a pokračuje syntetizovat specifické tkáně kolagen typu II a agrekan.
N. Tanaka a spoluautoři (1984) zkoumali difúzní vlastnosti různých přírodních molekul v alginátu a zjistili, že molekuly větší než 70 kD nejsou difundovány přes alginát. Takže kultivace buněk v alginátu je vhodná pro studium regulace biosyntézy matrice a organizace ECM. Dostupnost buněk kultivovaných v alginátu umožňuje zkoumat vliv peptidových regulačních faktorů a farmakologických činidel na transkripční, posttranskripční a translační hladiny.
Chondrocyty jsou také kultivovány v matrici typu kolagenových vláken I a II. S. Nehrer et al (1997), ve srovnání se operace u psů chondrocytů proteoglykan sebe kolagenem polymerní matrici obsahující kolageny různých typů. Byly zjištěny významné rozdíly v morfologii biosyntetické funkce chondrocytů kultivovaných v kolagenových matricích obsahujících kolagen typu I a II. Buňky v matrici kolagenu typu II stočily svůj sférický tvar, zatímco u kolagenu typu I měly fibroblastovou morfologii. Kromě toho v matrici kolagenu typu II produkují chondrocyty více glykosaminoglykanů. J. Van Susante a kol. (1995) porovnali vlastnosti chondrocytů kultivovaných v alginátu a kolagenu (typ I). Autoři zjistili významný nárůst počtu buněk v kolagenovém gelu, ale od 6. Dne kultivace buňky ztrácely charakteristický fenotyp, který se změnil na fibroblastové buňky. V alginátovém gelu byl pozorován pokles počtu buněk, ale chondrocyty si zachovaly svůj normální fenotyp. Množství kolagenu gelových proteoglykanů na buňku byly významně vyšší než v alginátu, avšak tento pokles byl pozorován v syntéze gelové matrice prvků, které začínají od 6. Dne kultivace, zatímco v alginátové syntéze pokračoval růst.
Pevná trojrozměrná fibrinová matrice je přirozená látka, která podporuje chondrocyty suspendované v diferencovaném fenotypu. 3D fibrinová matrice může být také použita jako nosič pro transplantaci chondrocytů. Výhodami fibrinu jsou absence cytotoxicity, schopnost vyplňovat prostor, schopnost lepidla. Tím, histologické a biochemické studie Autoren-diografii, elektronová mikroskopie ukázala, že chondrocyty ve fibrinové gely zachovat jejich morfologii, násobení a vyrobit matici i po 2 týdnech kultivace. Nicméně, G. Homminga et al (1993) uvádí, že po 3 dnech kultivace začíná rozklad fibrinu postupuje Dediferenciace chondrocytů.
Suspenze chondrocytů v umělém (syntetickém) ECM
Implantáty chrupavky pro rekonstrukční nebo ortopedickou chirurgii lze získat pěstováním izolovaných chondrocytů in vitro v syntetické biokompatibilní matrici.
Kultivované chondrocyty kyseliny polyglykolové proliferují a udržují normální morfologii a fenotyp během 8 týdnů. Komplex chondrocyt-polyglykolové kyseliny se skládá z buněk, glykosaminoglykanů, kolagenů a má vnější kolagenovou kapsli. Nicméně u takových implantátů existují dva typy molekul kolagenu - I a II. Implantáty dediferenciovaného chondrocytů řady průchodů mají větší množství glykosaminoglykanů a kolagenu než u implantátů z nediferencované primárních chondrocytů.
L. Freed a kol (1 993b) ve srovnání chování chondrocytů kultur člověka a skotu ve vláknitém polyglykolové kyseliny (EQAP) a v kyselině svár polilaktilovoy (PPLC). Po 6-8 týdnech kultivace býčích chondrocytů v HSVG nebo PPLC autoři pozorovali buněčnou proliferaci a regeneraci matrix chrupavky. V HSBC byly chondrocyty sférické, nacházející se v mezerách obklopených chrupavkovou matricí. Po 8 týdnech in vitro kultury regenerované tkáně obsahovalo až 50% sušiny (4% buněčné hmoty, 15% glykosaminoglykanů a 31% kolagenu). V PPLK byly buňky vřetenovité, malé množství glykosaminoglykanů a kolagenu. V HSBC byl buněčný růst dvakrát intenzivnější než u PTCA. V podmínkách in vivo, chondrocyty pěstované v HPVC a PPLC po dobu 1 až 6 měsíců produkovaly histologicky podobné tkáně chrupavky. Implantáty obsahovaly glykosaminoglykany, kolagen typu I a typu II.
Chondrocyty plodových býků byly kultivovány v porézním hydrofobním a hydrofilním polyethylenu s vysokou hustotou. Po 7 dnech inkubace v obou substrátech zůstaly buňky kulovitým tvarem, obsahujícím zejména kolagen typu II. Po 21 dnech kultivace se ukázalo, že hydrofilní matrice obsahuje více kolagenu typu II než hydrofobní matrice.
Tkáň chrupavky může být také získána kultivací v monovrstvě na filtrech Millicell-CM. Předběžné pokrytí filtrů kolagenem je nezbytné pro upevnění chondroitů. Histologické vyšetření kultury demonstruje akumulaci chondrocytů v proteinu ECM obsahujícím kolagen a typu II kolagen. Kolagen typu I v takové kultuře není detekován. Chondrocyty ve výsledné chrupavkové tkáni mají sférický tvar, ale na povrchu tkáně jsou poněkud zploštělé. Tloušťka nově vytvořené tkáně se časem zvyšovala a záviselo na počáteční hustotě monovrstvy buněk. Za optimálních podmínek kultivace dosáhla tloušťka chrupavkové tkáně 110 μm, organizace buněk a kolagenu v povrchové a hluboké vrstvě je podobná struktuře kloubní chrupavky. VKM obsahuje přibližně 3krát více kolagenu a proteoglykanů. Po 2 týdnech kultivace byla zaznamenána akumulace matice-sa, což umožnilo extrakci tkáně z filtru a jeho použití pro transplantaci.
Sims a kol. (1996) zkoumali kultivaci chondrocytů v polymerní matrici zapouzdřené v polyethylenoxidovém gelu, které umožňuje velké množství buněk, které mají být transportovány injekcí. Šest týdnů po injekci do podkožní tkáně athymických myší vznikla nová chrupavka, která byla morfologicky charakterizována bílou opalescenci podobnou hyalinní chrupavce. Údaje z histologických a biochemických studií naznačují přítomnost aktivně proliferujících chondrocytů, které produkují ECM.
Explantace
Vyšetření chrupavkové tkáně se používá ke studiu procesů ana- a katabolismu v ní, homeostáze, resorpce a opravy. Chondrocyty v explantátech chrupavkových tkání podporují normální fenotyp a složení ECM, podobně jako v kloubní chrupavce in vivo. Po 5 dnech kultivace v přítomnosti séra se dosáhne konstantní úrovně syntézy a přirozené degradace. Resorpce může urychlit tkáňové kultury a v hlavní kultuře s přídavkem séra za použití řady činidel, například, IL-IB, TNF-a, bakterialnyhlipopolisaharidov, deriváty retinové kyseliny nebo aktivní kyslíkové radikály. Pro studium jeho poškození opravy chrupavky je indukována rozpustných zánětlivých mediátorů (H 2 O 2, IL-1, TNF-a), nebo fyzikální prasknutí matrice.
Metoda organotypických kultur je model pro studium in vitro působení izolovaných vnějších faktorů na chondrocyty a okolní matrici. In vivo jsou chondrocyty zřídka umístěny v modulu ECM a nekontaktují se navzájem. Kultura explantované kloubní chrupavky si zachovává tuto strukturální organizaci, stejně jako zvláštní interakce mezi chondrocyty a jejich okolním extracelulárním prostředím. Tento model se také používá ke studiu vlivu mechanického stresu, farmakologických činitelů, růstových faktorů, cytokinů a hormonů na metabolismus chrupavky.
Další výhodou explantace tkáňového chrupavky je nepřítomnost poškození chondrocytů proteolytickými enzymy nebo mechanickým faktorem, který je nevyhnutelný, když jsou buňky izolovány. Receptory a jiné membránové proteiny a glykoproteiny jsou chráněny před škodlivými faktory.
Kultura chondronů
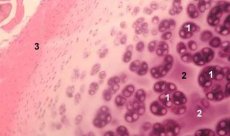
Hondron - strukturální, funkční a metabolické jednotky kloubní chrupavka se skládá z chondrocytů pericelulárních matrice a kompaktní vlákna kapsle a je zodpovědný za homeostázy matrice. Chondrony jsou mechanicky extrahovány z chrupavky a shromažďovány několika postupnými nízkorychlostními homogenizacemi. Izolované z oblastí různých hloubek hondrony chrupavky lze rozdělit do čtyř kategorií: jediné hondron, dvojité hondrony, násobek (tři nebo více), lineárně uspořádané hondrony (kolona hondronov) hondronov přetížení.
Jednoduché chondrony se obvykle nacházejí ve středních vrstvách intaktní chrupavky, spárované - na okraji středních a hlubokých vrstev, lineárně umístěné více chondronů jsou typické pro hluboké vrstvy intaktní chrupavky. Nakonec se shluky chondronů skládají z náhodně uspořádaných skupin jednorázových a párovaných chondronů, které po homogenizaci zachovávají agregovaný stav. Akumulace chondronů jsou velké fragmenty chrupavky, které obvykle obsahují několik chondronů a radiálně umístěných kolagenových vláken, tj. Typickou organizaci charakteristickou pro hluboké vrstvy matrice. Chondrony jsou imobilizovány v průhledné agarosy, což umožňuje studovat jejich strukturu, molekulární složení a metabolickou aktivitu. Hondron systém - agarózy považována za mikro modelu chrupavky, která se liší od tradičního systému chondrocytů - agarózy, který zachovává přírodní mikroprostředí, není zapotřebí provádět jeho syntézy a montáž. Kultivace chondronů je model pro studium interakcí buněk a matrice v kloubní chrupavce za normálních a patologických podmínek.
 [22], [23], [24], [25], [26], [27]
[22], [23], [24], [25], [26], [27]
Kultura nesmrtelných chondrocytů
Pro vytvoření trvalých buněčných linií se používají rekombinantní DNA nebo onkogenní viry, které mohou buňku "nesmrtelnou". Nesmrtelné chondrocyty mají schopnost nekonečné proliferace, udržování stabilního fenotypu. F. Mallein-Gerin et al (1995) ukázal, že onkogen je SV40T-indukovanou proliferaci myších chondrocytů, které tak nadále stabilní expresi kolageny II, IX a XI typy, stejně jako společný a agrekan vazebný protein. Taková buněčná linie však získává schopnost syntetizovat kolagen typu I při kultivaci v monovrstvé kultuře nebo v agarosovém gelu.
W. Horton a spoluautoři (1988) popisují řadu nesmrtelných buněk s nízkou hladinou exprese kolagenu typu II mRNA. Tyto buňky byly získány jejich transformací myším retrovirem obsahujícím I-myc- a y-ra-onkogeny. Tento typ buněk je jedinečným modelem pro studium interakcí kloubní matrice v nepřítomnosti kolagenu typu II, stejně jako regulace syntézy kolagenu typu II.
Kultivace chondropytů s mutovanými nebo deletovanými geny je vhodným modelem pro studium jejich fyziologické funkce. Tento model je vhodný zejména pro studium úlohy specifických molekul v organizacích matrix chrupavky nebo studium účinků různých regulačních faktorů na metabolismus chrupavky. Chondrocyty vzdálený genu syntetizovaný kolagen typu IX kolagenových fibril širší, než je normální, což naznačuje, že kolagen typu IX upravuje průměr vláken. Jak je uvedeno v kapitole 1, byla nedávno detekována mutace genu COLAI kódujícího kolagen typu II v rodinách s primární generalizovanou osteoartritidou. Pro studium vlivu mutovaného kolagenu typu II v kloubní matrix R. Dharmrvaram et al (1997) se provádí transfekce ( „kontaminace“ cizí nukleové kyseliny) defektní Kol 2 AI (arginin v poloze 519 je nahrazen cysteinem) v lidských fetálních chondrocytů in vitro.
Systém kokultiv. V kloubu interaguje chrupavka s buňkami jiných typů obsaženými v synoviální membráně, synoviální tekutině, vazy, subchondrální kosti. Metabolismus chondrocytů může být ovlivněn různými rozpustnými faktory syntetizovanými těmito buňkami. Kloubní chrupavka artritidy je proto zničena proteolytickými enzymy a volnými radikály, které jsou produkovány synoviálními buňkami. Proto byly vyvinuty modely pro studium komplexních interakcí mezi chrupavkou a okolními tkáněmi, které se nazývají kokultura.
S. Lacombe-gleise et al (1995) byly kultivovány králík chondrocyty a osteoblasty v kokultivačního systému (Costar), ve kterém byly buňky odděleny mikroporézní membránou (0,4 mikronů) umožňuje výměnu mezi dvěma typy buněk bez jakéhokoliv přímého styku. Tato studie prokázala schopnost osteoblastů stimulovat růst chondrocytů prostřednictvím rozpustných mediátorů.
A.M. Malfait a spoluautoři (1994) zkoumali vztah mezi monocyty periferní krve a chondrocytů. Tento model je vhodný pro studium procesů zprostředkovaných cytokiny, při zánětlivé artropatii (revmatoidní artritida, séronegativní spondylitida atd.). Autoři modelu oddělili buňky membránou s vazbou na proteiny s póry o průměru 0,4 μm. Studie zjistila, že lipopolysacharidu monocytů stimulovaných vypracovali iFNO IL-1-a, který inhibuje syntézu chondrocytů agrekanu a přispěl k degradaci již syntetizovaných agrekanu agregátů.
K. Tada et al (1994) vytvořil model kultivace, ve které byly endotelové buňky v kolagenu (I-typ) gel uveden do vnitřní komory z vnější komory od něj odděleno chondrocytů umístěných ve filtru s velikostí pórů 0,4 um. Ve stavu úplné izolace od vnější komory vytvořily lidské endoteliální buňky zkumavky v kolagenovém gelu v přítomnosti EGF nebo TGF-a. Při současném kultivaci obou typů TGF buněk byla inhibována závislá tvorba zkumavek endotelovými buňkami. Chondrocytová inhibice tohoto procesu byla částečně eliminována protilátkami proti TGF-beta. Lze předpokládat, že TGF-beta produkovaný chondrocyty snižuje vaskularizaci samotné chrupavky.
S. Groot a spoluautoři (1994) současně kultivovali chondrocyty z hypertrofických a proliferativních zón kosti 16-ti denní fetální myši s kousky mozkové tkáně. Po 4 dnech kultivace byla pozorována transdiferenciace chondrocytů na osteoblasty a nástup tvorby osteoidů. Po 11 dnech kultivace byla část chrupavky nahrazena kostní tkání a kostní matrice byla částečně kalcifikována. Některé neuropeptidy a neurotransmitery produkované mozkovou tkání ovlivňují metabolismus osteoblastů nebo mají na nich receptory. Mezi nimi lze izolovat norepinefrin, vasoaktivní intestinální peptid, peptid asociovaný s genem kalcitoninu, látku P a somatostatin. Při kultivaci chondrocytů mohou části mozkové tkáně produkovat některé z těchto faktorů, které mohou indukovat proces transdiferenciace chondrocytů do osteoblastů.
 [28], [29], [30], [31], [32], [33]
[28], [29], [30], [31], [32], [33]
Vliv vnějších faktorů na kulturu chondrocytů
Vliv napětí kyslíku na metabolismus chondrocytů
Ve většině případů se chondrocytové kultury vyvíjejí za podmínek atmosférického napětí kyslíku. Nicméně je dobře známo, že chondrocyty in vivo existují za hypoxických podmínek a napětí kyslíku se mění s různými patologickými podmínkami. Během procesu dozrávání jsou pozorovány významné změny v přívodu krve epifýz. Protože se vaskularizace mění v různých oblastech růstové destičky, napětí v kyslíku se v nich mění také. C. Brighton a R. Heppenstall (1971) prokázali, že v destičce tibie u králíků je napětí kyslíku v hypertrofické zóně menší než v okolní chrupavce. Měření některých metabolických parametrů ukázalo, že chondrocyty jsou schopny rychle reagovat na lokální změny koncentrace kyslíku. Za prvé, s nízkým napětím kyslíku, jeho spotřeba chondrocytů klesá. Se sníženým napětím kyslíku z 21 na 0,04% se zvyšuje využití glukózy, zvyšuje se aktivita enzymu glykolýzy a syntéza kyseliny mléčné. I při nízkém napětí kyslíku zůstává absolutní množství ATP, ADP a AMP stabilní. Tyto údaje naznačují směrovost metabolismu chondrocytů za účelem maximalizace úspory energie. Nicméně syntetická aktivita, a tedy i postupy reparace, se mění za podmínek hypoxie.
Vysoké napětí kyslíku také ovlivňuje metabolismus chondrocytů, což způsobuje pokles syntézy proteoglykanů a DNA, degradaci matrix chrupavky. Tyto účinky jsou zpravidla provázeny produkcí volných kyslíkových radikálů.
Vliv koncentrace iontů a osmotického tlaku prostředí na funkci chondrocytů
V nativní chrupavce se koncentrace iontů významně liší od koncentrace iontů v jiných tkáních: obsah sodíku v extracelulárním médiu je 250-350 mmol a jeho osmolarita je 350-450 mosmolů. Při izolaci chondrocytů z videorekordéru a inkubací ve standardním médiu (DMEM (Dulbeccovo minimální esenciální médium - Dulbeccovo minimální esenciální médium) osmolarita - 250-280,7 mOsm) mění ostře okolního prostředí buňky. Kromě toho je koncentrace vápníku a draslíku ve standardním médiu mnohem nižší než u původního tkáně a koncentrace aniontů je mnohem vyšší.
Přidání sacharózy do média vede ke zvýšení její osmolarity a vyvolává přechodné intracelulární zvýšení koncentrace H + a vápenatých aniontů v cytosolu. Takové intracelulární změny mohou ovlivnit proces diferenciace chondrocytů a jejich metabolickou aktivitu. J. Urban et al (1993) zjistili, že začlenění 35 8-sulfátu a 3 H-prolin izolovaných chondrocyty inkubovány v DMEM standardním médiu po dobu 2-4 hodin, byl pouze 10%, který v nativní tkáni. Intenzita Syntéza vyvrcholila, když je osmolarita extracelulárním médiu 350-400 mOsm v nově izolovaných chondrocyty a chrupavkových explantátů v. Kromě toho se objem chondrocytů zvýšil o 30 až 40% po vložení izolovaných buněk do standardního DMEM média s uvedenou osmolaritou. Nicméně, když kultivované chondrocyty pod nefyziologické osmolarity po dobu 12-16 hodin, buňky adaptované na nové prostředí snížením intenzity střihu je úměrná biosyntéza Osmolarita extracelulárním médiu.
P. Borgetti et al (1995) zkoumali vliv osmolarity extracelulárního média na růst, morfologii a biosyntézu prasečích chondrocytů. Autoři prokázali podobné biochemické a morfologické vlastnosti chondrocytů kultivovaných v médiu s osmolaritou 0,28 a 0,38 mosmol. Při 0,48 mOsm osmolarita média během prvních 4-6 hodin kultivace byl pozorován pokles v buněčné proliferaci a syntézu proteinů, ale následně došlo k obnovení těchto parametrů, které nakonec dosáhla kontrolní hodnoty. Při kultivaci chondrocytů v médiu s 0,58 mOsm osmolarity buňky ztratí svou schopnost podporovat fyziologický intenzity proliferační procesy a po 6 dnech se výrazně sníží počet chondrocytů. Při osmolaritě média, 0,58 mosmol, je pozorována hluboká inhibice syntézy proteinů. Kromě toho, při kultivaci v médiu s osmolaritou mOsm 0,28-0,38 chondrocyty udržet fyziologické fenotyp při vyšší osmolaritu (mOsm 0,48-0,58) významné změny v buněčné morfologii, což se projevuje ztráta charakteristický fenotyp chondrocytů konverze do buněk podobných fibroblastům, stejně jako ztráta buněk, schopnost shromažďovat matricové proteoglykany. Výsledky této studie naznačují schopnost chondrocytů reagovat na omezené oscilace osmolality v extracelulárním prostředí.
Změna koncentrace jiných iontů může také ovlivnit procesy biosyntézy v chondrocytech. To znamená, že míra inkorporace 35 S (síran) se zvyšuje o polovinu s rostoucí koncentrací draslíku iontů 5 mM (koncentrace ve standardním prostředí DM EM) do 10 mM (koncentrace v ECM in vivo). Koncentrace vápníku nižší než 0,5 mmol podporoval tvorbu kolagenu podle zralých chondrocyty skotu, zatímco koncentrace 1-2 mm (odpovídá koncentraci ve standardním prostředí DM EM) způsobila významné snížení syntézy kolagenu. Mírné zvýšení biosyntézy bylo pozorováno u vysokých hladin vápníku (2-10 mmol). Různé kationty se podílejí na připojení chondrocytů k proteinům VKM. Takže ionty hořčíku a manganu zajišťují připevnění k fibronektinu a kolagenu typu II, zatímco vápenaté ionty se neúčastní na připojení chondrocytů k bílkovinám. Proto výsledky studií popsaných demonstraci účinku změn extracelulárních iontů draslíku, sodíku, vápníku a osmolarity média na funkci chondrocytů biosyntetické inkubované ve standardním médiu.
Vliv mechanického namáhání na metabolismus chondrocytů
Společná imobilizace je reverzibilní atrofie chrupavky, což ukazuje na potřebu mechanické stimuly pro normální průběh metabolických procesů v videorekordéru. Ve většině případů existují modely buněčné kultury, které existují za podmínek normálního atmosférického tlaku. M. Wright a spoluautoři (1996) ukázali, že mechanické prostředí ovlivňuje metabolismus chondrocytů, reakce buněk závisí na intenzitě a frekvenci kompresního zatížení. Pokusy s nakládáním na explantáty intaktní kloubní chrupavky in vitro prokázaly pokles syntézy proteinů a proteoglykanů působením statického zatížení, zatímco dynamické zatížení stimuluje tyto procesy. Přesné mechanismy pro provádění mechanických zatížení účinky na komplexu chrupavky, a pravděpodobně souvisí s kmen buňky, hydrostatického tlaku, osmotického tlaku, elektrický potenciál a receptory na povrchu buněk molekul matrice. Abychom studovali vliv každého z těchto parametrů, je třeba vytvořit systém, v němž lze jeden parametr nezávisle měnit. Například explantní kultura není vhodná pro studium deformace buněk, ale může být použita ke studiu celkového vlivu tlaku na metabolickou aktivitu chondrocytů. Komprese chrupavky vede do buňky deformaci, a rovněž doprovázena výskytem hydrostatického tlakového spádu, elektrického potenciálu a toku tekutiny změny fyzikálně-chemické faktory, jako je obsah vody v matrici, hustoty elektrického náboje, úroveň osmotického tlaku. Deformaci buněk lze studovat za použití izolovaných chondrocytů ponořených do agarózového nebo kolagenového gelu.
Bylo vyvinuto několik systémů pro studium účinku mechanické stimulace na kultivaci chondrocytů. Někteří výzkumníci používají systémy pro tento účel, při kterých se tlak na buněčnou kulturu provádí v plynné fázi. Například JP Veldhuijzen et al (1979), s použitím přetlaku 13 kPa při nízké frekvenci (0,3 Hz) během 15 minut, pozorováno zvýšení syntézy cAMP a proteoglykany a spouštění syntézu DNA. R. Smith et al (1996) ukázal, že přerušovaná expozice primárních kultur chondrocytů býka hydrostatického tlaku (10 MPa) při 1 Hz po dobu 4 hodin způsobil zvýšení syntézy agrekanu a kolagenu typu II, zatímco konstantní tlak neměl žádný vliv na tyto procesy. Použitím podobného systému M. Wright et al (1996) uvádějí, že cyklický tlak na buněčné kultuře je spojena s hyperpolarizaci buněčné membráně chondrocytů a aktivace Ca 2+ -dependentních draslíkových kanálků. Účinky cyklického tlaku jsou tedy zprostředkovány iontovými kanály aktivovanými protažením v chondrocytové membráně. Chondrocyt reakce na hydrostatický tlak závisí na podmínkách buněčné kultivace, a frekvence aplikovaného zatížení. Tak, cyklický hydrostatický tlak (5 MPa) snižuje inkorporaci sulfátu do chondrocytů monovrstvy při frekvenci 0,05, 0,25 a 0,5 Hz, zatímco pro frekvence nad 0,5 Hz síranem začleňování v zvyšuje explantátu chrupavky.
M. Bushmann a kol. (1992) uvádějí, že chondrocyty v agarózovém gelu mění biosyntézu v reakci na statický a dynamický mechanický stres, stejně jako kultivovaný nedotčený orgán. Autoři zjistili, že mechanická zátěž způsobuje hyperosmotický stimulační účinek, následovaný poklesem pH v chondrocytech.
Účinek mechanického roztahování může být studován na kultuře buněk ponořených do gelu. Napínací síla může být vytvořena pomocí počítačem řízeného vakua. Když je systém v určitém stupni vakua, dno Petriho misky s kulturou buněk byla prodloužena o známé množství, maximální deformace na okrajích spodní části kalíšku a minimální ve středu. Protahování se přenáší a kultivuje v petri misce chondrocytů. Při použití této metody, Holm-Vall K. Et al (1995) ukázal, že kultivované na kolagen (typ II), gel chondrosarkom buňky zvýšila expresi mRNA a 2 -integrina. 2 p r integrinu je schopná vázat se na kolagen typu II. Je považován za mechanoreceptor, protože interaguje s proteiny vázajícími aktin, čímž spojuje ECM a cytoskeleton.
Vliv pH na metabolismus chondrocytů
Hodnota pH intersticiální tekutiny ECM chrupavkové tkáně je mnohem kyselější než u jiných tkání. A. Maroudas (1980) stanovil pH kloubní chrupavky při 6,9. W. Diamant a spoluautoři (1966) zjistili pH 5,5 v patologických podmínkách. Je známo, že chondrocyty žijí při nízkém PO2, což signalizuje důležitou roli glykolýzy (95% celkového metabolismu glukózy) v metabolismu těchto buněk; glykolýza je doprovázena produkcí velkého množství kyseliny mléčné.
Další acidifikační glykolýza produkty jsou důležité složky samotné matrice. Velký počet pevných záporného náboje na extracelulární proteoglykanů modifikuje iontové složení: existuje vysoká koncentrace volných kationtů (například H +, Na +, K + ) a nízké koncentraci aniontů (např., O2, NPHS). Kromě toho, v důsledku působení mechanického zatížení dochází k odvádění vody ze zprávy ECM, která vede ke zvýšení koncentrací pevných záporných nábojů a přilákat více kationtů v matici. Pak následuje snížení pH extracelulárního média, která ovlivňuje intracelulární pH, a tím se mění metabolismus chondrocytů. R. Wilkin a A. Hall (1995) zkoumali vliv pH na extracelulární a intracelulární prostředí matrice biosyntézy izolovány chondrocyty skotu. Pozorovali dvojí modifikaci syntézy matrice se snížením pH. Mírný pokles pH (7,4
 [34], [35], [36], [37], [38], [39], [40]
[34], [35], [36], [37], [38], [39], [40]
Vliv složení kultivačního média na metabolismus chondrocytů
Médium pro kultivaci chondrocytů musí odpovídat experimentálním podmínkám. V posledních letech bylo telecí sérum použito k optimalizaci podmínek kultivace. Při sére je však třeba vzít v úvahu řadu důležitých bodů:
- vnější růst buněk z periferie tkáně v kulturních kulturách,
- variabilita složení sér různých sérií,
- přítomnost neznámých součástí v nich,
- zvýšené riziko interference, artefakty ve studii vlivu různých biologických faktorů na metabolickou aktivitu buněk.
Příkladem této studie je studie vlivu EGF na chondrocyty chrupavky u potkanů. EGF stimulované inkorporace 3 H-thymidinu a zvýšení obsahu DNA v kultuře. Tento účinek byl výraznější při nízkých sérových koncentracích (<1%), ale při vysokých koncentracích (> 7,5%) účinek zmizel.
Je dobře známo, že úrovně syntézy a degradace v DMEM obohacené telecím sérem jsou významně zvýšeny ve srovnání s podmínkami in vivo. Rozdíly mezi metabolizací in vivo a in vitro mohou být způsobeny rozdíly mezi synoviální tekutinou a prostředím, ve kterém jsou buňky kultivovány. D. Lee et al (1997) byly kultivovány chondrocytů mladých býků agarózy pomocí živného média obsahujícího DMEM, obohacené o 20% telecího séra a velké množství alogenní normální synoviální tekutiny. Přítomnost synoviální tekutiny v médiu vyvolala zvýšení počtu proteoglykanů až na 80% celkového objemu synoviální tekutiny. Získané výsledky ukazují, že synoviální tekutina v kultuře indukuje rychlost metabolismu podobnou in vivo, s vysokou úrovní syntézy glykosaminoglykanů a nízkou hladinou dělení buněk.
G. Verbruggen et al (1995) ukázal, že syntéza 35 S-arrpeKaHa lidských chondrocytů kultivované v agaróze v DMEM bez séra bylo 20 až 30% úrovně syntézy pozorované v DMEM, doplněném 10% telecího séra. Autoři určit rozsah, ve kterém IGF-1, IGF-2, TGF-P nebo snížení produkce inzulínu agrekanu v médiu bez séra. Autoři dospěli k závěru, že se 100 ng / ml inzulínu, IGF-1 nebo IGF-2 částečně snížené syntézy agrekanu na 39-53% úrovně kontroly. Při kombinaci těchto faktorů nebyly zjištěny žádné synergické nebo kumulativní jevy. Ve stejné době, 10 ng / ml TGF-P v přítomnosti 100 ng / ml inzulinu stimulované syntézy agrekanu až 90% nebo více z referenční úrovně. Konečně, sérový transferin, samotný nebo v kombinaci s inzulínem, neovlivnil syntézu agreganu. Bovinní sérový albumin obsah agrekanu agregátů při výměně telecího séra výrazně snížila. Obohatení média pro inzulínovou kulturu, IGF nebo TGF-P částečně obnovilo schopnost buněk produkovat agregáty agreganu. V tomto případě je IGF-1 a inzulín schopen udržovat homeostázu v buněčných kulturách. Po 40 dnech kultivace v médiu doplněném 10-20 ng / ml IGF-1, proteoglykan syntéza byla udržována na stejné úrovni, nebo dokonce vyšší ve srovnání s médiem obsahujícím 20% telecí sérum. Katabolické procesy pomalu postupoval v médiu doplněném IGF-1, než v médiu doplněném 0,1% roztoku albuminu, ale poněkud rychleji v médiu doplněném 20% sérem. V dlouhodobě žijících kulturách zachovává 20 ng / ml IGF-1 stabilní stav buněk.
D. Lee et al (1993), ve srovnání účinek na složení kultivačního média (DMEM, DMEM + 20% telecí sérum, DMEM + 20 ng / ml IGF-1) na syntézu DNA v kultuře explantátu chrupavky, jednovrstevné kultuře a v suspenzi v agaróze . Při kultivaci v agaróze za přítomnosti séra autoři pozorovali tendenci seskupovat chondrocyty do velkých klastrů. Buňky kultivované bez séra a s IGF1, zachovávají kruhový tvar v agaróze, byly shromážděny v malých skupinách, ale netvoří velké agregáty. V monovrstvě byla syntéza DNA významně vyšší v médiu obsahujícím sérum než v médiu obohaceném IGF-1; Syntéza DNA v této oblasti byla mnohem vyšší než v neprošlé oblasti. Při kultivaci chondrocytů v suspenzi v agaróze v nekoncentrované médium a v médiu s IGF-1, žádný rozdíl v syntéze DNA. Současně se suspenze kultivaci chondrocytů v agaróze v médiu doplněném sérem, byla doprovázena zvýšeným začleněním radionukleotid 3 -thymidinu ve srovnání s jinými prostředí.
Vitamin C je nezbytný pro aktivaci enzymů, které se podílejí na tvorbě stabilní spirální struktury kolagenních fibril. Chondrocyty, které jsou ve vztahu k kyselině askorbové nedostatečné, syntetizují podhydroxylované ne-helikální prekurzory kolagenu, které jsou pomalu sekretovány. Zavedení kyseliny askorbové (50 μg / ml) způsobuje hydroxylaci kolagenu typu II a IX a jejich sekreci v normálních množstvích. Přidání vitaminu C neovlivnilo úroveň syntézy proteoglykanů. V důsledku toho se sekrece kolagenu reguluje nezávisle na sekreci proteoglykanů.

