Lékařský expert článku
Nové publikace
Syntéza, sekrece a metabolismus katecholaminů
Naposledy posuzováno: 06.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Dřeň nadledvin produkuje sloučeniny se strukturou, která se od steroidů velmi liší. Obsahují 3,4-dihydroxyfenylové (katecholové) jádro a nazývají se katecholaminy. Patří mezi ně adrenalin, noradrenalin a dopamin beta-hydroxytyramin.
Sekvence syntézy katecholaminů je poměrně jednoduchá: tyrosin → dihydroxyfenylalanin (DOPA) → dopamin → norepinefrin → adrenalin. Tyrosin se do těla dostává s potravou, ale může se také tvořit z fenylalaninu v játrech působením fenylalaninhydroxylázy. Konečné produkty přeměny tyrosinu v tkáních jsou různé. V dřeni nadledvin proces pokračuje do fáze tvorby adrenalinu, v zakončeních sympatických nervů - norepinefrinu, v některých neuronech centrálního nervového systému končí syntéza katecholaminů tvorbou dopaminu.
Přeměna tyrosinu na DOPA je katalyzována tyrosinhydroxylázou, jejímiž kofaktory jsou tetrahydrobiopterin a kyslík. Předpokládá se, že tento enzym omezuje rychlost celého procesu biosyntézy katecholaminů a je inhibován konečnými produkty procesu. Tyrosinhydroxyláza je hlavním cílem regulačních účinků na biosyntézu katecholaminů.
Přeměnu DOPA na dopamin katalyzuje enzym DOPA dekarboxyláza (kofaktor - pyridoxalfosfát), který je relativně nespecifický a dekarboxyluje další aromatické L-aminokyseliny. Existují však náznaky možnosti modifikace syntézy katecholaminů změnou aktivity tohoto enzymu. Některým neuronům chybí enzymy pro další přeměnu dopaminu a ten je konečným produktem. Jiné tkáně obsahují dopamin beta-hydroxylázu (kofaktory - měď, kyselina askorbová a kyslík), která přeměňuje dopamin na norepinefrin. V dřeni nadledvin (ale ne v zakončeních sympatických nervů) je přítomen fenylethanolamin - methyltransferáza, která tvoří adrenalin z norepinefrinu. V tomto případě slouží S-adenosylmethionin jako donor methylových skupin.
Je důležité si uvědomit, že syntéza fenylethanolamin-N-methyltransferázy je indukována glukokortikoidy vstupujícími do dřeně z kůry přes portální žilní systém. To může vysvětlovat skutečnost, že v jednom orgánu jsou sloučeny dvě různé endokrinní žlázy. Význam glukokortikoidů pro syntézu adrenalinu je zdůrazněn skutečností, že buňky dřeně nadledvin, které produkují noradrenalin, se nacházejí kolem arteriálních cév, zatímco buňky produkující adrenalin přijímají krev převážně z žilních sinusů umístěných v kůře nadledvin.
K rozkladu katecholaminů dochází hlavně pod vlivem dvou enzymatických systémů: katechol-O-methyltransferázy (COMT) a monoaminooxidázy (MAO). Hlavní dráhy rozkladu adrenalinu a noradrenalinu jsou schematicky znázorněny na obr. 54. Pod vlivem COMT v přítomnosti donoru methylové skupiny S-adrenosylmethioninu se katecholaminy přeměňují na normetanefrin a metanefrin (3-O-methylderiváty noradrenalinu a adrenalinu), které se pod vlivem MAO přeměňují na aldehydy a poté (v přítomnosti aldehydoxidázy) na kyselinu vanillylmandlovou (VMA), hlavní produkt rozkladu noradrenalinu a adrenalinu. Ve stejném případě, když jsou katecholaminy zpočátku vystaveny MAO spíše než COMT, přeměňují se na 3,4-dioxomandlový aldehyd a poté pod vlivem aldehydoxidázy a COMT na kyselinu 3,4-dioxomandlovou a VMC. Za přítomnosti alkoholdehydrogenázy může z katecholaminů vznikat 3-methoxy-4-oxyfenylglykol, který je hlavním konečným produktem degradace adrenalinu a noradrenalinu v CNS.
Rozklad dopaminu je podobný, až na to, že jeho metabolity postrádají hydroxylovou skupinu na beta-uhlíku, a proto se místo kyseliny vanilylmandlové tvoří kyselina homovanilová (HVA) neboli kyselina 3-methoxy-4-hydroxyfenyloctová.
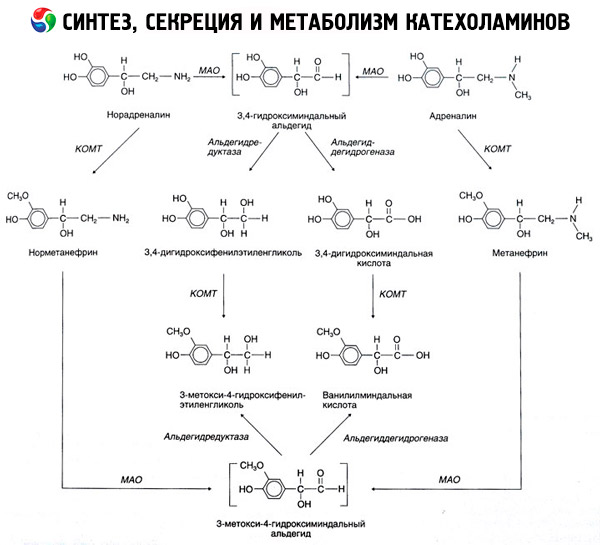
Předpokládá se také existence chinoidní dráhy oxidace molekuly katecholaminu, která může produkovat meziprodukty s výraznou biologickou aktivitou.
Norepinefrin a adrenalin vzniklé působením cytosolických enzymů v sympatických nervových zakončeních a dřeni nadledvin vstupují do sekrečních granulí, které je chrání před působením degradačních enzymů. Zachycení katecholaminů granulemi vyžaduje výdej energie. V chromafinních granulích dřeně nadledvin jsou katecholaminy pevně vázány na ATP (v poměru 4:1) a specifické proteiny - chromograniny, což brání difúzi hormonů z granulí do cytoplazmy.
Přímým stimulem pro sekreci katecholaminů je zřejmě průnik vápníku do buňky, stimulující exocytózu (fúze membrány granulí s buněčným povrchem a jejich protržení s úplným uvolněním rozpustného obsahu - katecholaminů, dopamin beta-hydroxylázy, ATP a chromograninů - do extracelulární tekutiny).
Fyziologické účinky katecholaminů a jejich mechanismus účinku
Účinky katecholaminů začínají interakcí se specifickými receptory cílových buněk. Zatímco receptory pro hormony štítné žlázy a steroidní hormony jsou lokalizovány uvnitř buněk, receptory pro katecholaminy (stejně jako pro acetylcholin a peptidové hormony) jsou přítomny na vnějším povrchu buňky.
Dlouhodobě je prokázáno, že v některých reakcích jsou adrenalin nebo noradrenalin účinnější než syntetický katecholamin isoproterenol, zatímco v jiných je účinek isoproterenolu lepší než účinky adrenalinu nebo noradrenalinu. Na tomto základě byla vyvinuta koncepce o přítomnosti dvou typů adrenoreceptorů v tkáních: alfa a beta, přičemž v některých z nich může být přítomen pouze jeden z těchto dvou typů. Isoproterenol je nejsilnějším agonistou beta-adrenoreceptorů, zatímco syntetická sloučenina fenylefrin je nejsilnějším agonistou alfa-adrenoreceptorů. Přirozené katecholaminy - adrenalin a noradrenalin - jsou schopny interagovat s receptory obou typů, ale adrenalin vykazuje větší afinitu k beta- a noradrenalin k alfa-receptorům.
Katecholaminy aktivují srdeční beta-adrenergní receptory silněji než beta-receptory hladkého svalstva, což umožnilo rozdělení beta typu na podtypy: beta1-receptory (srdce, tukové buňky) a beta2-receptory (průdušky, cévy atd.). Účinek isoproterenolu na beta1-receptory převyšuje účinek adrenalinu a noradrenalinu pouze 10krát, zatímco na beta2-receptory působí 100–1000krát silněji než přirozené katecholaminy.
Použití specifických antagonistů (fentolamin a fenoxybenzamin pro alfa- a propranolol pro beta-receptory) potvrdilo adekvátnost klasifikace adrenoreceptorů. Dopamin je schopen interagovat s alfa- i beta-receptory, ale různé tkáně (mozek, hypofýza, cévy) mají také své vlastní dopaminergní receptory, jejichž specifickým blokátorem je haloperidol. Počet beta-receptorů se pohybuje od 1000 do 2000 na buňku. Biologické účinky katecholaminů zprostředkované beta-receptory jsou obvykle spojeny s aktivací adenylátcyklázy a zvýšením intracelulárního obsahu cAMP. Přestože jsou receptor a enzym funkčně propojeny, jedná se o různé makromolekuly. Guanosintrifosfát (GTP) a další purinové nukleotidy se podílejí na modulaci aktivity adenylátcyklázy pod vlivem hormon-receptorového komplexu. Zvýšením aktivity enzymu se zdá, že snižují afinitu beta receptorů k agonistům.
Fenomén zvýšené citlivosti denervovaných struktur je již dlouho známý. Naopak dlouhodobá expozice agonistům citlivost cílových tkání snižuje. Studium beta receptorů umožnilo tyto jevy vysvětlit. Bylo prokázáno, že dlouhodobá expozice isoproterenolu vede ke ztrátě citlivosti adenylátcyklázy v důsledku snížení počtu beta receptorů.
Proces desenzibilizace nevyžaduje aktivaci syntézy proteinů a je pravděpodobně způsoben postupnou tvorbou ireverzibilních komplexů hormon-receptor. Naopak zavedení 6-oxidopaminu, který ničí sympatická zakončení, je doprovázeno zvýšením počtu reagujících beta-receptorů v tkáních. Je možné, že zvýšení aktivity sympatického nervového systému způsobuje také věkem podmíněnou desenzibilizaci cév a tukové tkáně ve vztahu ke katecholaminům.
Počet adrenoreceptorů v různých orgánech může být řízen jinými hormony. Estradiol tak zvyšuje a progesteron snižuje počet alfa-adrenoreceptorů v děloze, což je doprovázeno odpovídajícím zvýšením a snížením její kontraktilní odpovědi na katecholaminy. Pokud je intracelulární „druhý poslem“ vytvořený působením agonistů beta-receptorů jistě cAMP, pak je situace s ohledem na přenašeče alfa-adrenergních účinků složitější. Předpokládá se existence různých mechanismů: snížení hladiny cAMP, zvýšení obsahu cAMP, modulace buněčné dynamiky vápníku atd.
K reprodukci různých účinků v těle jsou obvykle zapotřebí dávky adrenalinu, které jsou 5–10krát menší než u noradrenalinu. Ačkoli je noradrenalin účinnější ve vztahu k a- a beta1-adrenoreceptorům, je důležité si uvědomit, že oba endogenní katecholaminy jsou schopny interagovat s alfa- i beta-receptory. Biologická odpověď daného orgánu na adrenergní aktivaci proto do značné míry závisí na typu receptorů, které jsou v něm přítomny. To však neznamená, že selektivní aktivace nervového nebo humorálního spojení sympaticko-adrenálního systému je nemožná. Ve většině případů je pozorována zvýšená aktivita jeho různých vazeb. Obecně se tedy uznává, že hypoglykémie reflexně aktivuje dřeň nadledvin, zatímco pokles krevního tlaku (posturální hypotenze) je doprovázen především uvolňováním noradrenalinu ze zakončení sympatických nervů.
Adrenoreceptory a účinky jejich aktivace v různých tkáních
Systém, orgán |
Typ adrenergního receptoru |
Reakce |
Kardiovaskulární systém: |
||
Srdce |
Beta |
Zvýšená srdeční frekvence, vodivost a kontraktilita |
Arterioly: |
||
Kůže a sliznice |
Alfa |
Snížení |
Kosterní svaly |
Beta |
Expanze Kontrakce |
Břišní orgány |
Alfa (více) |
Snížení |
Beta |
Rozšíření |
|
Žíly |
Alfa |
Snížení |
Dýchací systém: |
||
Svaly průdušek |
Beta |
Rozšíření |
Trávicí systém: |
||
Žaludek |
Beta |
Snížené motorické dovednosti |
Střeva |
Alfa |
Kontrakce svěračů |
Slezina |
Alfa |
Snížení |
Beta |
Relaxace |
|
Exokrinní slinivka břišní |
Alfa |
Snížená sekrece |
Urogenitální systém: |
Alfa |
Kontrakce svěrače |
Měchýř |
Beta |
Relaxace vyhazovacího svalu |
Mužské genitálie |
Alfa |
Ejakulace |
Oči |
Alfa |
Rozšíření zornic |
Kůže |
Alfa |
Zvýšené pocení |
Slinné žlázy |
Alfa |
Vylučování draslíku a vody |
Beta |
Sekrece amylázy |
|
Endokrinní žlázy: |
||
Ostrůvky slinivky břišní |
||
Beta buňky |
Alfa (více) |
Snížená sekrece inzulínu |
Beta |
Zvýšená sekrece inzulínu |
|
Alfa buňky |
Beta |
Zvýšená sekrece glukagonu |
8 článků |
Beta |
Zvýšená sekrece somatostatinu |
Hypotalamus a hypofýza: |
||
Somatotrofy |
Alfa |
Zvýšená sekrece STH |
Beta |
Snížená sekrece STH |
|
Laktotrofy |
Alfa |
Snížená sekrece prolaktinu |
Tyreotrofi |
Alfa |
Snížená sekrece TSH |
Kortikotrofy |
Alfa |
Zvýšená sekrece ACTH |
| beta | Snížená sekrece ACTH | |
Štítná žláza: |
||
Folikulární buňky |
Alfa |
Snížená sekrece tyroxinu |
Beta |
Zvýšená sekrece tyroxinu |
|
Parafolikulární (K) buňky |
Beta |
Zvýšená sekrece kalcitoninu |
Příštítná tělíska |
Beta |
Zvýšená sekrece PTH |
Ledviny |
Beta |
Zvýšená sekrece reninu |
Žaludek |
Beta |
Zvýšená sekrece gastrinu |
BX |
Beta |
Zvýšená spotřeba kyslíku |
Játra |
? |
Zvýšená glykogenolýza a glukoneogeneze s uvolňováním glukózy; zvýšená ketogeneze s uvolňováním ketonových tělísek |
Tuková tkáň |
Beta |
Zvýšená lipolýza s uvolňováním volných mastných kyselin a glycerolu |
Kosterní svaly |
Beta |
Zvýšená glykolýza s uvolňováním pyruvátu a laktátu; snížená proteolýza se sníženým uvolňováním alaninu a glutaminu |
Je důležité vzít v úvahu, že výsledky intravenózního podání katecholaminů ne vždy adekvátně odrážejí účinky endogenních sloučenin. To platí zejména pro norepinefrin, protože v těle se uvolňuje převážně nikoli do krve, ale přímo do synaptických štěrbin. Endogenní norepinefrin proto aktivuje například nejen vaskulární alfa receptory (zvýšený krevní tlak), ale i beta receptory srdce (zvýšená srdeční frekvence), zatímco podání norepinefrinu zvenčí vede především k aktivaci vaskulárních alfa receptorů a reflexnímu (přes vagus) zpomalení srdeční frekvence.
Nízké dávky adrenalinu aktivují převážně beta receptory svalových cév a srdce, což vede ke snížení periferního cévního odporu a zvýšení srdečního výdeje. V některých případech může převážit první účinek a po podání adrenalinu se rozvine hypotenze. Ve vyšších dávkách adrenalin aktivuje také alfa receptory, což je doprovázeno zvýšením periferního cévního odporu a na pozadí zvýšení srdečního výdeje vede ke zvýšení arteriálního tlaku. Jeho účinek na cévní beta receptory je však také zachován. V důsledku toho zvýšení systolického tlaku převyšuje podobný ukazatel diastolického tlaku (zvýšení pulzního tlaku). Se zavedením ještě vyšších dávek začínají převažovat alfa-mimetické účinky adrenalinu: systolický a diastolický tlak se zvyšují paralelně, jako pod vlivem norepinefrinu.
Vliv katecholaminů na metabolismus se skládá z jejich přímých a nepřímých účinků. První z nich se realizují hlavně prostřednictvím beta receptorů. Složitější procesy jsou spojeny s játry. Ačkoli je zvýšená jaterní glykogenolýza tradičně považována za výsledek aktivace beta receptorů, existují také důkazy o zapojení alfa receptorů. Nepřímé účinky katecholaminů jsou spojeny s modulací sekrece mnoha dalších hormonů, jako je inzulín. V účinku adrenalinu na jeho sekreci jednoznačně převládá alfa adrenergní složka, protože bylo prokázáno, že jakýkoli stres je doprovázen inhibicí sekrece inzulínu.
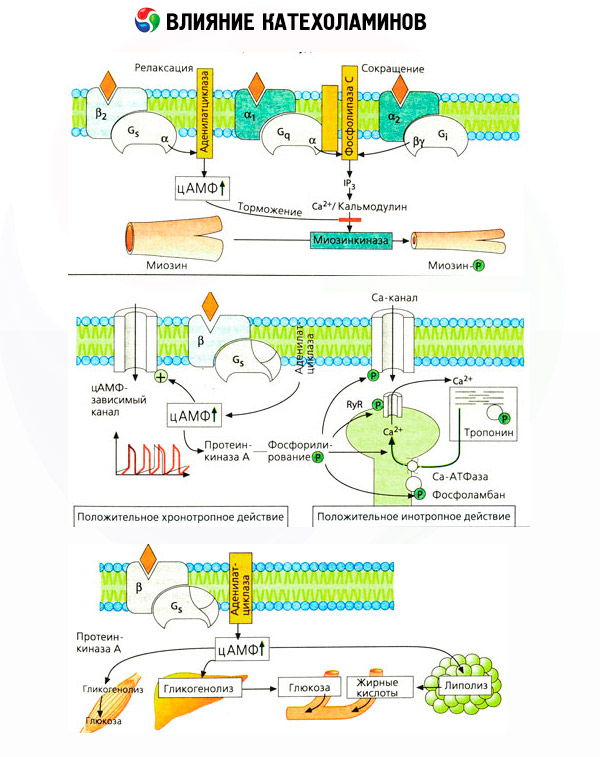
Kombinace přímých a nepřímých účinků katecholaminů způsobuje hyperglykémii, spojenou nejen se zvýšenou produkcí glukózy v játrech, ale také s inhibicí jejího využití periferními tkáněmi. Zrychlení lipolýzy způsobuje hyperlipacidemii se zvýšeným přísunem mastných kyselin do jater a zesílením produkce ketonových tělísek. Zvýšená glykolýza ve svalech vede ke zvýšenému uvolňování laktátu a pyruvátu do krve, které spolu s glycerolem uvolňovaným z tukové tkáně slouží jako prekurzory jaterní glukoneogeneze.
Regulace sekrece katecholaminů. Podobnost produktů a reakčních metod sympatického nervového systému a dřeně nadledvin byla základem pro sloučení těchto struktur do jediného sympaticko-adrenálního systému těla s rozdělením jeho nervových a hormonálních vazeb. Různé aferentní signály jsou koncentrovány v hypotalamu a centrech míchy a prodloužené míchy, odkud pocházejí eferentní zprávy, které přecházejí do buněčných těl pregangliových neuronů umístěných v postranních rozích míchy na úrovni VIII krčních - II-III bederních segmentů.
Pregangliové axony těchto buněk opouštějí míchu a vytvářejí synaptická spojení s neurony umístěnými v gangliích sympatického řetězce nebo s buňkami dřeně nadledvin. Tato pregangliová vlákna jsou cholinergní. Prvním zásadním rozdílem mezi sympatickými postgangliovými neurony a chromafinními buňkami dřeně nadledvin je to, že ty druhé přenášejí cholinergní signál, který přijímají, nikoli nervovým vedením (postgangliové adrenergní nervy), ale humorální cestou, čímž uvolňují adrenergní sloučeniny do krve. Druhým rozdílem je, že postgangliové nervy produkují norepinefrin, zatímco buňky dřeně nadledvin produkují hlavně adrenalin. Tyto dvě látky mají odlišné účinky na tkáně.

