Lékařský expert článku
Nové publikace
Příčiny a patogeneze záškrtu
Last reviewed: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Záškrt je vzorem toxigenních infekčních onemocnění. V roce 1883 Klebs prokázal, že původcem záškrtu je Corynebacterium diphtheriae. O rok později Loeffler zjistil, že organismus lze kultivovat pouze z nosohltanové dutiny, a navrhl, že poškození vnitřních orgánů je způsobeno rozpustným toxinem. V roce 1888 Roux a Yersin prokázali, že zvířata injikovaná sterilními filtráty C. diphtheriae vyvíjejí orgánovou patologii nerozeznátelnou od lidské záškrtu; to prokázalo, že hlavním faktorem virulence je silný exotoxin.
Záškrt je nejčastější infekce horních cest dýchacích, která způsobuje horečku, bolest v krku a malátnost. V místě (místech) infekce se často tvoří silná, šedozelená fibrinová membrána, pseudomembrána, v důsledku kombinovaného působení bakteriálního růstu, produkce toxinů, nekrózy podkladové tkáně a imunitní odpovědi hostitele. Poznání, že systémové poškození orgánů je způsobeno působením záškrtového toxinu, vedlo k vývoji jak účinné terapie založené na antitoxinu pro léčbu akutní infekce, tak i vysoce účinné toxoidní vakcíny.
Přestože očkování toxoidy učinilo ze záškrtu vzácné onemocnění v oblastech, kde standardy veřejného zdraví vyžadují očkování, k ohniskům záškrtu stále dochází u neočkovaných a imunokompromitovaných skupin. Naproti tomu k rozsáhlým ohniskům záškrtu dosahujícím epidemických rozměrů došlo v oblastech, kde byly aktivní imunizační programy pozastaveny.
Jiné druhy korynebakterií
Kromě C. diphtheriae, C. ulcerans a C. pseudotuberculosis mohou občas způsobovat infekce nosohltanu a kůže i C. pseudodiphtheriticum a C. xerosis. Poslední dva kmeny jsou rozpoznatelné podle své schopnosti produkovat pyrazinamidázu. Ve veterinární medicíně jsou C. renale a C. kutscheri významnými patogeny, které způsobují pyelonefritidu u skotu a latentní infekce u myší.
Příčiny
Původce záškrtu, Corynebacterium diphtheriae, je tenká, mírně zakřivená tyčinka s kyjovitými ztluštěními na koncích, nehybná; netvoří spory, kapsle ani bičíky a je grampozitivní.
Kromě toxinu produkují difterické korynebakterie během svých životních procesů neuraminidázu, hyaluronidázu, hemolyzin, nekrotizující a difúzní faktory, které mohou způsobit nekrózu a zkapalnění hlavní látky pojivové tkáně.
Na základě schopnosti tvořit toxiny se difterické korynebakterie dělí na toxigenní a netoxigenní.
Difterický toxin je silný bakteriální exotoxin, který určuje celkové i lokální klinické projevy onemocnění. Toxigenita je geneticky podmíněna. Netoxigenní korynebakterie záškrtu onemocnění nezpůsobují.
Podle kulturních a morfologických znaků se všechny difterické korynebakterie dělí na 3 varianty: gravis, mitis, intermedius. Neexistuje žádná přímá závislost závažnosti onemocnění na variantě difterických korynebakterií. Každá varianta obsahuje toxigenní i netoxigenní kmeny. Toxigenní korynebakterie všech variant produkují identický toxin. [ 1 ]
Struktura, klasifikace a typy antigenů
Corynebacterium diphtheriae je grampozitivní, nepohyblivá tyčinka kyjovitého tvaru. Kmeny rostoucí v tkáni nebo starší kultury in vitro obsahují v buněčných stěnách jemné skvrny, které umožňují odbarvování během Gramova barvení a vedou k variabilní Gramově reakci. Starší kultury často obsahují metachromatické granule (polymetafosfát), které se methylenovou modří barví modrofialově. Mezi cukry buněčné stěny patří arabinóza, galaktóza a manóza. Kromě toho lze izolovat toxický 6,6'-ester trehalózy, který obsahuje kyseliny korynemykolové a korynemykolenové v ekvimolárních koncentracích. Rozlišují se tři odlišné typy kultur: mitis, intermedius a gravis.
Většina kmenů potřebuje pro růst kyselinu nikotinovou a pantothenovou; některé také thiamin, biotin nebo kyselinu pimelovou. Pro optimální produkci difterického toxinu musí být médium doplněno aminokyselinami a musí být odloženo.
Již v roce 1887 popsal Loeffler izolaci avirulentních (netoxigenních) kmenů C. diphtheriae, které byly nerozeznatelné od virulentních (toxigenních) kmenů izolovaných od pacientů u zdravých jedinců. Nyní je známo, že avirulentní kmeny C. diphtheriae mohou být po infekci a lyzogenizaci jedním z řady odlišných korynebakteriofágů nesoucích strukturní gen pro difterický toxin, tox. Lysogenní přeměna avirulentního na virulentní fenotyp může probíhat jak in situ, tak in vitro. Strukturní gen pro difterický toxin není nezbytný ani pro korynebakteriofága, ani pro C. diphtheriae. Navzdory tomuto pozorování nebyl genetický drift difterického toxinu pozorován.
Patogeneze
Vstupními body infekce jsou sliznice orofaryngu, nosu, hrtanu, méně často sliznice očí a genitálií, dále poškozená kůže, poraněné nebo popálené povrchy, opruzeniny, nezhojená pupeční rána. V místě vstupu se difterická korynebakterie množí a vylučuje exotoxin.
Exsudát bohatý na fibrinogen se vylučuje a pod vlivem trombokinázy uvolňované během nekrózy epiteliálních buněk se přeměňuje na fibrin. Vzniká fibrinózní film - charakteristický znak záškrtu.
Asymptomatické nosičství v nosohltanu je běžné v oblastech endemických pro záškrt. U vnímavých jedinců způsobují toxigenní kmeny onemocnění replikací a sekrecí záškrtového toxinu v nosohltanu nebo kožních lézích. Záškrtové léze jsou často pokryty pseudomembránou složenou z fibrinu, bakterií a zánětlivých buněk. Záškrtový toxin lze proteolyticky štěpit na dva fragmenty: N-terminální fragment A (katalytická doména) a fragment B (transmembránová a receptorově vázající doména). Fragment A katalyzuje NAD+-dependentní ADP-ribosylaci elongačního faktoru 2, čímž inhibuje syntézu proteinů v eukaryotických buňkách. Fragment B se váže na receptor na buněčném povrchu a usnadňuje doručení fragmentu A do cytosolu.
Ochranná imunita zahrnuje protilátkovou odpověď na difterický toxin po klinickém onemocnění nebo na difterický toxin (toxin inaktivovaný formaldehydem) po imunizaci.
Kolonizace
O faktorech, které zprostředkovávají kolonizaci C. diphtheriae, je známo jen málo. Je však zřejmé, že k virulenci přispívají i jiné faktory než produkce difterického toxinu. Epidemiologické studie ukázaly, že daný lysotyp může v populaci přetrvávat po dlouhou dobu. Později může být nahrazen jiným lysotypem. Vznik a následná dominance nového lysotypu v populaci pravděpodobně souvisí s jeho schopností kolonizovat a efektivně konkurovat ve svém segmentu nasofaryngeální ekologické niky. Corynebacterium diphtheriae může produkovat neuraminidázu, která štěpí kyselinu sialovou na buněčném povrchu na její složky pyruvát a kyselinu N-acetylneuraminovou. Šňůrový faktor (6,6'-di-O-mykoloyl-α, α'-D-trehalóza) je povrchovou složkou C. diphtheriae, ale jeho role v kolonizaci lidského hostitele není jasná.
Produkce záškrtových toxinů
Strukturní gen difterického toxinu, tox, patří do rodiny blízce příbuzných korynebakteriofágů, z nichž β-fág je nejlépe prozkoumaný. Regulace exprese difterického toxinu je zprostředkována železem aktivovaným represorem DtxR, který je kódován genomem C. diphtheriae. Exprese toxinu závisí na fyziologickém stavu C. diphtheriae. Za podmínek, kdy se železo stává substrátem limitujícím rychlost růstu, se železo disociuje z DtxR, aktivuje se gen toxicodendron a difterický toxin je syntetizován a vylučován do kultivačního média maximální rychlostí.
Difterický toxin je neobvykle silný; pro vnímavé druhy (např. lidi, opice, králíky, morčata) je smrtelná dávka již od 100 do 150 ng/kg tělesné hmotnosti. Difterický toxin se skládá z jediného polypeptidového řetězce o 535 aminokyselinách. Biochemická, genetická a rentgenová strukturní analýza ukazuje, že toxin se skládá ze tří strukturních/funkčních domén:
- N-terminální ADP-ribosyltransferáza (katalytická doména);
- oblast, která usnadňuje doručení katalytické domény přes buněčnou membránu (transmembránová doména);
- vazebná doména receptoru eukaryotických buněk.
Po mírném trypsinovém štěpení a redukci za denaturačních podmínek lze difterický toxin specificky štěpit v místě své proteázově citlivé smyčky na dva polypeptidové fragmenty (A a B). Fragment A je N-terminální 21 kDa složka toxinu a obsahuje katalytické místo pro ADP-ribosylaci elongačního faktoru 2 (EF-2).
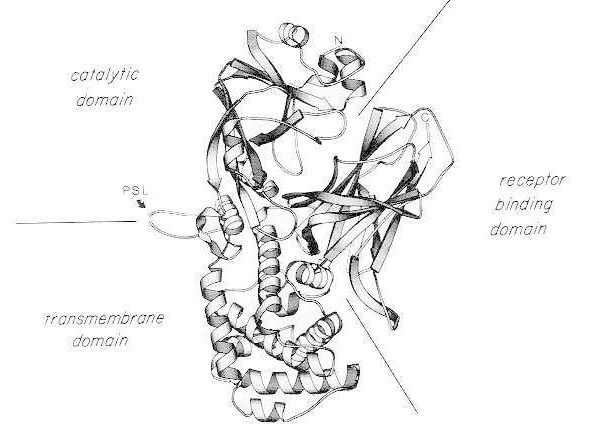
Páskový diagram rentgenové krystalové struktury monomerního nativního difterického toxinu. (upraveno z Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). Jsou znázorněny relativní polohy katalytických, transmembránových a receptor-vazebných domén. Intaktní toxin může být štěpen trypsin-like proteázami v polohách Arg190, Arg192 a/nebo Arg193, které se nacházejí v proteázově citlivé smyčce (PSL). Po redukci disulfidového můstku mezi Cys186 a Cys201 může být toxin rozdělen na fragmenty A a B. Jsou znázorněny amino-konec (N) a karboxy-konec (C) intaktního toxinu. Páskový diagram byl vytvořen pomocí programu MOLESCRIPT.
C-terminální fragment, fragment B, nese transmembránovou a receptorově vázající doménu toxinu.
Otrava jedné eukaryotické buňky difterickým toxinem zahrnuje nejméně čtyři odlišné kroky:
- vazba toxinu na jeho receptor na povrchu buňky;
- shlukování nabitých receptorů do potažených jamek a internalizace toxinu prostřednictvím receptorem zprostředkované endocytózy; po okyselení endocytového vezikula membránově asociovanou protonovou pumpou řízenou ATP,
- vložení transmembránové domény do membrány a usnadnění doručení katalytické domény do cytosolu a
- ADP-ribosylace EF-2, což vede k nevratnému potlačení syntézy proteinů.
Ukázalo se, že jediná molekula katalytické domény dodaná do cytosolu je pro buňku smrtelná.
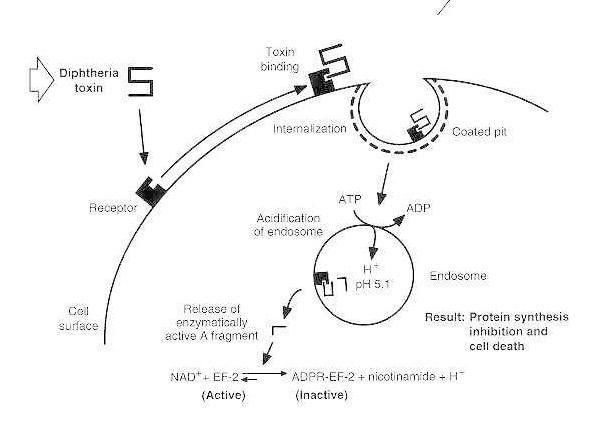
Schéma intoxikace záškrtem u citlivé eukaryotické buňky.
Toxin se váže na svůj receptor na buněčném povrchu a je internalizován prostřednictvím receptorem zprostředkované endocytózy; po okyselení endosomu je transmembránová doména vložena do membrány vezikul; katalytická doména je doručena do cytosolu, což vede k inhibici syntézy proteinů a buněčné smrti.
Epidemiologie
Před masovou imunizací populace USA difterickým toxoidem byl záškrt obvykle dětským onemocněním. Pozoruhodným aspektem masové imunizace difterickým toxoidem je, že s rostoucím procentem populace s ochrannými hladinami imunity proti toxinu (≥ 0,01 IU/ml) klesá frekvence izolace toxigenních kmenů z populace. Dnes je ve Spojených státech, kde klinický záškrt téměř úplně vymizel, izolace toxigenních kmenů C. diphtheriae vzácná. Protože subklinická infekce již neposkytuje zdroj expozice antigenu záškrtu a pokud není posílena, imunita vůči antitoxinu klesá, velké procento dospělých (30 až 60 %) má hladiny antitoxinu pod ochrannými hladinami a je ohroženo. Ve Spojených státech, Evropě a východní Evropě se nedávná ohniska záškrtu vyskytla především u osob zneužívajících alkohol a/nebo drogy. V rámci této skupiny mají nositelé toxigenního C. diphtheriae středně vysokou úroveň antitoxické imunity. Nedávné zhroucení opatření veřejného zdraví v Rusku vedlo k tomu, že se záškrt stal epidemií. Do konce roku 1994 bylo v Rusku hlášeno více než 80 000 případů a více než 2 000 úmrtí.
Lokální ohniska záškrtu jsou téměř vždy spojena s nositelem imunity, který se vrátil z oblasti, kde je záškrt endemický. Nedávná ohniska klinického záškrtu ve Spojených státech a Evropě byla skutečně spojována s cestovateli vracejícími se z Ruska a východní Evropy. Toxigenní kmeny C. diphtheriae se přenášejí přímo z člověka na člověka vzdušnými kapénkami. Je známo, že toxigenní kmeny mohou přímo kolonizovat nosohltanovou dutinu. Kromě toho se toxigenní gen může šířit nepřímo uvolněním toxigenního korynebakteriofága a lysogenní transformací netoxigenního autochtonního C. diphtheriae in situ. [ 5 ]
Kromě stanovení biotypu a lysotypu izolátů C. diphtheriae lze nyní ke studiu ohnisek záškrtu použít techniky molekulární biologie. Ke studiu klinických ohnisek se používají vzorce štěpení chromozomální DNA C. diphtheriae restrikčními endonukleázami, stejně jako použití klonovaných inzerčních sekvencí korynebakterií jako genetické sondy.
Schickův test se již mnoho let používá k posouzení imunity vůči difterickému toxinu, ačkoli byl v mnoha oblastech nyní nahrazen sérologickým testem na specifické protilátky proti difterickému toxinu. Při Schickově testu se malé množství difterického toxinu (přibližně 0,8 ng v 0,2 ml) injekčně aplikuje intradermálně do předloktí (testovací místo) a 0,0124 μg difterického toxinu v 0,2 ml se aplikuje intradermálně do kontrolního místa. Měření se provádí po 48 a 96 hodinách. Nespecifické kožní reakce obvykle vrcholí po 48 hodinách. Po 96 hodinách erytematózní reakce s možnou nekrózou v testovaném místě naznačuje nedostatečnou antitoxickou imunitu k neutralizaci toxinu (≤ 0,03 IU/ml). Zánět v testované i kontrolní oblasti po 48 hodinách naznačuje hypersenzitivní reakci na antigenní přípravek.
Formuláře
Corynebacterium diphtheriae infikuje nosohltan nebo kůži. Toxigenní kmeny produkují silný exotoxin, který může způsobit záškrt. Mezi příznaky záškrtu patří faryngitida, horečka a otok krku nebo oblasti kolem kožní léze. Záškrtové léze jsou pokryty pseudomembránou. Toxin se šíří krevním řečištěm do vzdálených orgánů a může způsobit paralýzu a městnavé srdeční selhání. [ 6 ]
Existují dva typy klinického záškrtu: nosohltanový a kožní. Příznaky faryngeálního záškrtu sahají od mírné faryngitidy až po hypoxii v důsledku obstrukce dýchacích cest pseudomembránou. Postižení krčních lymfatických uzlin může způsobit silný otok krku (záškrt typu býčího krku) a pacient se může rozvinout horečkou (≥ 38 °C). Kožní léze u kožního záškrtu jsou obvykle pokryty šedohnědou pseudomembránou. V důsledku působení záškrtového toxinu na periferní motorické neurony a myokard se mohou vyvinout život ohrožující systémové komplikace, zejména ztráta motorických funkcí (např. potíže s polykáním) a městnavé srdeční selhání.
Řízení
Kontrola záškrtu závisí na adekvátní imunizaci záškrtovým toxoidem: záškrtovým toxinem inaktivovaným formaldehydem, který zůstává antigenně intaktní. Toxoid se připravuje inkubací záškrtového toxinu s formaldehydem při teplotě 37 °C za alkalických podmínek. Imunizace proti záškrtu by měla začít ve druhém měsíci života sérií tří základních dávek v intervalech 4 až 8 týdnů, po nichž následuje čtvrtá dávka přibližně 1 rok po poslední základní vakcinaci. Záškrtový toxoid se široce používá jako součást vakcíny proti záškrtu, pertusi a tetanu (DPT). Epidemiologické studie ukázaly, že imunizace proti záškrtu je účinná přibližně z 97 %. Přestože se ve Spojených státech a Evropě provádí hromadná imunizace proti záškrtu a míra proočkovanosti dětí je dostatečná, velká část dospělé populace může mít titry protilátek pod ochrannými hladinami. Dospělí by měli být revakcinováni záškrtovým toxoidem každých 10 let. Cestující do oblastí s vysokým výskytem endemického záškrtu (Střední a Jižní Amerika, Afrika, Asie, Rusko a východní Evropa) by skutečně měli dostat posilovací dávku toxoidu záškrtu a tetanu. V posledních letech minimalizovalo používání vysoce purifikovaných toxoidních přípravků k imunizaci občasné závažné hypersenzitivní reakce. Posilovací dávka toxoidu záškrtu a tetanu by měla být podána cestujícím do oblastí s vysokým výskytem endemického záškrtu (Střední a Jižní Amerika, Afrika, Asie, Rusko a východní Evropa). V posledních letech minimalizovalo používání vysoce purifikovaných toxoidních přípravků k imunizaci občasné závažné hypersenzitivní reakce. Posilovací dávka toxoidu záškrtu a tetanu by měla být podána cestujícím do oblastí s vysokým výskytem endemického záškrtu (Střední a Jižní Amerika, Afrika, Asie, Rusko a východní Evropa). V posledních letech minimalizovalo používání vysoce purifikovaných toxoidních přípravků k imunizaci občasné závažné hypersenzitivní reakce.
Přestože se antibiotika (jako je penicilin a erythromycin) používají jako součást léčby pacientů se záškrtem, rychlá pasivní imunizace difterickým antitoxinem je nejúčinnější při snižování úmrtnosti. Dlouhý poločas rozpadu specifického antitoxinu v krevním řečišti je důležitým faktorem pro zajištění účinné neutralizace difterického toxinu; aby však byl antitoxin účinný, musí s toxinem reagovat, než může vstoupit do buňky.
Reengineering difterického toxinu pro vývoj eukaryotických receptorově specifických cytotoxinů
Proteinové inženýrství je nový a rychle se rozvíjející obor molekulární biologie; kombinuje metodologie rekombinantní DNA a syntézu DNA na pevné fázi za účelem návrhu a konstrukce chimérických genů, jejichž produkty mají jedinečné vlastnosti. Studie vztahů mezi strukturou a funkcí difterického toxinu jasně ukázaly, že tento toxin je protein se třemi doménami: katalytickou, transmembránovou a receptorovou. Bylo možné geneticky nahradit nativní vazebnou doménu difterického toxinu pro receptor různými polypeptidovými hormony a cytokiny (např. α-melanocyty stimulující hormon [α-MSH], interleukin (IL) 2, IL-4, IL-6, IL-7, epidermální růstový faktor). Výsledné chimérické proteiny nebo fúzní toxiny kombinují specificitu vazby cytokinu na receptor s transmembránovou a katalytickou doménou toxinu. V každém případě bylo prokázáno, že fúzní toxiny selektivně otravují pouze ty buňky, které nesou odpovídající cílový receptor. První z těchto geneticky modifikovaných fúzních toxinů, DAB 389IL-2, je v současné době hodnocen v klinických studiích na lidech pro léčbu refrakterních lymfomů a autoimunitních onemocnění, u kterých hrají buňky s vysoce afinitními receptory IL-2 důležitou roli v patogenezi.[ 7 ] Ukázalo se, že podávání DAB 389 IL-2 je bezpečné, dobře snášené a schopné vyvolat trvalou remisi onemocnění bez závažných vedlejších účinků. Je pravděpodobné, že fúzní toxiny na bázi difterického toxinu se stanou důležitými novými biologickými činidly pro léčbu specifických nádorů nebo onemocnění, u kterých lze cílit na specifické receptory na buněčném povrchu.


 [
[