Lékařský expert článku
Nové publikace
Patogeneze hepatitidy B
Naposledy posuzováno: 07.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
V patogenezi hepatitidy B lze identifikovat několik hlavních článků patogenetického řetězce:
- zavedení patogenu - infekce;
- fixace na hepatocytu a penetrace do buňky;
- množení viru a jeho „vytlačování“ na povrch hepatocytů, stejně jako do krve;
- aktivace imunologických reakcí zaměřených na eliminaci patogenu;
- poškození orgánů a systémů imunitními komplexy;
- tvorba imunity, osvobození od patogenu, zotavení.
Vzhledem k tomu, že k infekci hepatitidou B vždy dochází parenterálně, lze předpokládat, že okamžik infekce je prakticky ekvivalentní průniku viru do krve. Pokusy některých výzkumníků rozlišit enterální a regionální fázi hepatitidy B jsou málo podložené. Existuje více důvodů se domnívat, že virus se do jater okamžitě dostává s krevním oběhem.
Tropismus viru hepatitidy B k jaterní tkáni je předurčen přítomností speciálního receptoru v HBsAg - polypeptidu s molekulovou hmotností 31 000 Da (P31), který má aktivitu vázající albumin. Podobná albuminová zóna se nachází také na membráně hepatocytů v játrech lidí a šimpanzů, což v podstatě určuje tropismus HBV k játrům lidí a šimpanzů.
Když virus pronikne do hepatocytu, uvolní se virová DNA, která po vstupu do jádra hepatocytu a fungování jako matrice pro syntézu nukleových kyselin spustí řadu postupných biologických reakcí, jejichž výsledkem je sestavení nukleokapsidy viru. Nukleokapsida migruje přes jadernou membránu do cytoplazmy, kde dochází ke konečnému sestavení Daneových částic - kompletního viru hepatitidy B.
Je však třeba poznamenat, že když je hepatocyt infikován, proces může probíhat dvěma způsoby - replikativním a integrativním. V prvním případě se vyvíjí obraz akutní nebo chronické hepatitidy a ve druhém - virové nosičství.
Důvody, které určují oba typy interakce mezi virovou DNA a hepatocyty, nebyly přesně stanoveny. Typ reakce je s největší pravděpodobností podmíněn geneticky.
Výsledkem replikační interakce je sestavení struktur jádrového antigenu (v jádře) a sestavení kompletního viru (v cytoplazmě), následované prezentací kompletního viru nebo jeho antigenů na membráně nebo ve struktuře membrány hepatocytů.
Obecně se uznává, že replikace viru nevede k poškození buněk na úrovni hepatocytů, protože virus hepatitidy B nemá cytopatický účinek. Tento postoj nelze považovat za nesporný, protože je založen na experimentálních datech, která sice naznačují absenci cytopatického účinku viru hepatitidy B, ale byla získána na tkáňových kulturách, a proto je nelze plně extrapolovat na virovou hepatitidu B u lidí. V každém případě otázka absence poškození hepatocytů během replikační fáze vyžaduje další studium.
Avšak bez ohledu na povahu interakce viru s buňkou jsou játra nutně zahrnuta do imunopatologického procesu. V tomto případě je poškození hepatocytů spojeno s tím, že v důsledku exprese virových antigenů na membráně hepatocytů a uvolnění virových antigenů do volného oběhu je zahrnut řetězec sekvenčních buněčných a humorálních imunitních reakcí, jejichž konečným cílem je odstranění viru z těla. Tento proces probíhá v plném souladu s obecnými vzorci imunitní odpovědi na virové infekce. K eliminaci patogenu jsou zahrnuty buněčné cytotoxické reakce zprostředkované různými třídami efektorových buněk: K buňkami, T buňkami, přirozenými zabíječi, makrofágy. Během těchto reakcí jsou infikované hepatocyty zničeny, což je doprovázeno uvolňováním virových antigenů (HBcAg, HBeAg, HBsAg), které spouštějí systém protilátekogeneze, v důsledku čehož se v krvi hromadí specifické protilátky, především proti jádru - anti-HBc a e-antigenu - anti-HBE. V důsledku toho dochází k uvolnění jaterní buňky z viru v procesu její smrti v důsledku reakcí buněčné cytolýzy.
Zároveň se specifické protilátky hromadící se v krvi vážou na virové antigeny a vytvářejí imunitní komplexy fagocytované makrofágy a vylučované ledvinami. V tomto případě se mohou objevit různé léze imunokomplexů ve formě glomerulonefritidy, arteritidy, artralgie, kožních vyrážek atd. Za účasti specifických protilátek se tělo očistí od patogenu a dochází k úplnému uzdravení.
V souladu s načrtnutou koncepcí patogeneze hepatitidy B je veškerá rozmanitost klinických variant průběhu onemocnění obvykle vysvětlována zvláštnostmi interakce viru a spoluprací imunokompetentních buněk, jinými slovy silou imunitní odpovědi na přítomnost virových antigenů. Podle moderních konceptů je síla imunitní odpovědi geneticky určena a spojena s histokompatibilními antigeny lokusu HLA první třídy.
Obecně se uznává, že za podmínek adekvátní imunitní odpovědi na virové antigeny se akutní hepatitida klinicky rozvíjí s cyklickým průběhem a úplným zotavením. Na pozadí snížení imunitní odpovědi na virové antigeny je imunitně zprostředkovaná cytolýza projevena nevýznamně, proto nedochází k účinné eliminaci infikovaných jaterních buněk, což vede k mírným klinickým projevům s dlouhodobou perzistencí viru a případně k rozvoji chronické hepatitidy. Naopak v případě geneticky podmíněné silné imunitní odpovědi a masivní infekce (hemotransfuze) vznikají rozsáhlé oblasti poškození jaterních buněk, které klinicky odpovídají těžkým a maligním formám onemocnění.
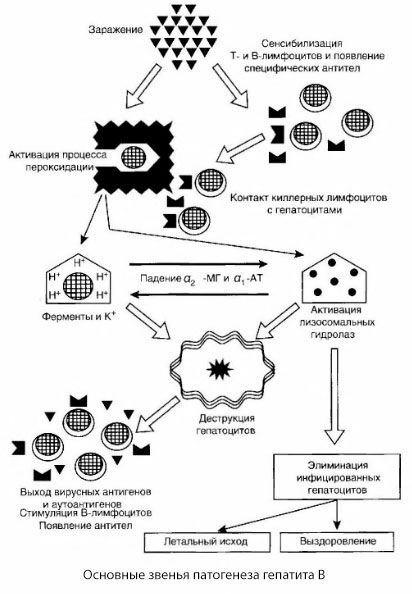
Předložené schéma patogeneze hepatitidy B se vyznačuje svou soudržností, obsahuje však řadu kontroverzních a málo prozkoumaných bodů.
Pokud se budeme řídit konceptem hepatitidy B jako imunopatologického onemocnění, můžeme očekávat nárůst buněčných cytotoxicity s rostoucí závažností onemocnění. U těžkých forem jsou však indexy buněčné imunity prudce sníženy, včetně několikanásobného poklesu ve srovnání se zdravými dětmi, a indexu cytotoxicity K-buněk. U maligní formy je v období rozvoje masivní jaterní nekrózy a zejména jaterního kómatu zaznamenána úplná neschopnost lymfocytů k blastové transformaci pod vlivem fytohematlutininu, stafylokokového endotoxinu a HBsAg. Kromě toho chybí schopnost leukocytů migrovat podle inhibiční reakce migrace leukocytů (LMIC) a podle výsledků jejich studií s fluorescenční tetracyklinovou sondou je zjištěn prudký nárůst propustnosti membrán lymfocytů.
Pokud jsou tedy indexy fluorescence lymfocytů u zdravých lidí 9,9 ± 2 % a u typické hepatitidy B s benigním průběhem se zvyšují na 22,3 ± 2,7 %, pak u maligních forem dosahuje počet fluorescenčních lymfocytů průměrně 63,5 ± 5,8 %. Vzhledem k tomu, že zvýšení propustnosti buněčných membrán je v literatuře jednoznačně hodnoceno jako spolehlivý ukazatel jejich funkční méněcennosti, lze usoudit, že u hepatitidy B, zejména u maligní formy, dochází k hrubému poškození lymfocytů. To dokazují i indexy cytotoxicity K-buněk. U těžké formy je v 1. až 2. týdnu onemocnění cytotoxicita 15,5 ± 8,8 % a u maligní formy v 1. týdnu 6,0 ± 2,6, ve 2. týdnu 22,0 ± 6,3 % s normou 44,8 ± 2,6 %.
Prezentovaná data jasně ukazují na výrazné poruchy buněčné imunity u pacientů s těžkými formami hepatitidy B. Je také zřejmé, že k těmto změnám dochází sekundárně v důsledku poškození imunokompetentních buněk toxickými metabolity a případně i cirkulujícími imunitními komplexy.
Jak ukázaly studie, u pacientů s těžkými formami hepatitidy B, zejména v případě rozvoje masivní nekrózy jater, klesá titr HBsAg a HBeAg v krevním séru a zároveň se začínají detekovat protilátky proti povrchovému antigenu ve vysokých titrech, což je zcela netypické pro benigní formy onemocnění, u kterých se anti-HBV objevují až ve 3. až 5. měsíci onemocnění.
Rychlé vymizení antigenů viru hepatitidy B se současným výskytem vysokých titrů antivirových protilátek naznačuje intenzivní tvorbu imunitních komplexů a jejich možnou účast v patogenezi rozvoje masivní nekrózy jater.
Faktické materiály nám tedy neumožňují jednoznačně interpretovat hepatitidu B pouze z hlediska imunopatologické agrese. A nejde jen o to, že nebyla nalezena žádná souvislost mezi hloubkou a prevalencí morfologických změn v játrech na jedné straně a závažností faktorů buněčné imunity na straně druhé. Teoreticky by se tato okolnost dala vysvětlit pozdními fázemi studia indikátorů buněčné imunity, kdy byly imunokompetentní buňky vystaveny silným toxickým účinkům v důsledku rostoucí funkční insuficience jater. Lze samozřejmě předpokládat, že k imunitní cytolýze hepatocytů dochází v nejranějších stádiích infekčního procesu, možná ještě před objevením se klinických příznaků těžkého poškození jater. Takový předpoklad je však nepravděpodobný, protože podobné indikátory buněčné imunity byly zjištěny u pacientů s nejakutnějším (bleskovým) průběhem onemocnění a navíc při morfologickém vyšetření jaterní tkáně nebyla zjištěna masivní lymfocytární infiltrace, zatímco současně byla zjištěna souvislá pole nekrotického epitelu bez jevů resorpce a lymfocytární agrese.
Je velmi obtížné vysvětlit morfologický obraz akutní hepatitidy pouze z hlediska imunitní buněčné cytolýzy, proto v raných studiích nebyl cytotoxický účinek viru hepatitidy B vyloučen.
V současné době byl tento předpoklad částečně potvrzen objevem viru hepatitidy B. Jak ukázaly studie, frekvence detekce markerů hepatitidy D přímo závisí na závažnosti onemocnění: u mírných forem jsou detekovány u 14 %, středně těžkých u 18 %, těžkých u 30 % a maligních u 52 % pacientů. Vzhledem k tomu, že virus hepatitidy D má nekrózogenní cytopatický účinek, lze považovat za prokázané, že koinfekce viry hepatitidy B a D má velký význam pro rozvoj fulminantních forem hepatitidy B.
Patogenezi hepatitidy B lze prezentovat následovně. Po průniku viru hepatitidy B do jaterních buněk je vyvolán imunologický útok na infikované jaterní buňky pomocí T-killerů, kteří vylučují lymfotoxiny směrem k jaterním buňkám.
Přesné mechanismy poškození hepatocytů u hepatitidy B dosud nebyly objasněny. Hlavní roli hrají aktivované procesy lipidové peroxidace a lysozomální hydrolázy. Spouštěčem mohou být lymfotoxiny uvolňované z efektorových buněk při jejich kontaktu s hepatocyty, ale je možné, že iniciátorem peroxidačních procesů může být samotný virus. Následně se patologický proces s největší pravděpodobností vyvíjí v následujícím pořadí.
- Interakce agresivního faktoru (lymfotoxinů nebo viru) s biologickými makromolekulami (možná se složkami membrán endoplazmatického retikula schopnými účastnit se detoxikačních procesů, analogicky s jinými škodlivými látkami, jak bylo prokázáno v souvislosti s tetrachlormethanem).
- Tvorba volných radikálů, aktivace procesů lipidové peroxidace a zvýšená propustnost všech hepatocelulárních membrán (syndrom cytolýzy).
- Pohyb biologicky aktivních látek podél koncentračního gradientu - ztráta enzymů různých intracelulárních lokalizací, donorů energie, draslíku atd. Akumulace sodíku a vápníku v buňkách, posun pH směrem k intracelulární acidóze.
- Aktivace a uvolňování lysozomálních hydroláz (RNAázy, DNAázy, katepsinů atd.) s rozpadem jaterních buněk a uvolňováním autoantigenů.
- Stimulace T- a B-imunitních systémů s tvorbou specifické senzibilizace T-lymfocytů na jaterní lipoproteiny, jakož i tvorba antihepatických humorálních autoprotilátek.
V navrhovaném schématu patogeneze hepatitidy B je spouštěcím faktorem virové antigeny, jejichž intenzivní produkce je pozorována v nejranějších stádiích onemocnění a po celou dobu akutního období, s výjimkou maligních forem, u kterých produkce virových antigenů prakticky ustává v době rozvoje masivní nekrózy jater, což předurčuje rychlý pokles replikace viru.
Je také zřejmé, že virové antigeny aktivují T- a B-systémy imunity. Během tohoto procesu dochází k charakteristické redistribuci subpopulací T-lymfocytů, jejímž cílem je organizace adekvátní imunitní odpovědi, eliminace infikovaných hepatocytů, neutralizace virových antigenů, sanogeneze a zotavení.
Když imunokompetentní buňky interagují s virovými antigeny na membránách hepatocytů nebo během reprodukce viru uvnitř hepatocytu, vznikají podmínky pro aktivaci procesů lipidové peroxidace, která, jak je známo, řídí propustnost všech buněčných a subcelulárních membrán.
Z této pozice se stává pochopitelným výskyt cytolýzního syndromu, zvýšené propustnosti buněčných membrán, která je tak přirozená a vysoce charakteristická pro virovou hepatitidu.
Konečným výsledkem syndromu cytolýzy může být úplné přerušení oxidativní fosforylace, únik buněčného materiálu a odumření jaterního parenchymu.
V naprosté většině případů však tyto procesy nezískávají tak fatální vývoj. Pouze u maligních forem onemocnění probíhá patologický proces lavinovitě a nevratně, protože dochází k masivní infekci, výraznému imunitnímu procesu, nadměrné aktivaci peroxidačních procesů a lysozomálních hydrodáz a k autoimunitním agresivním jevům.
Stejné mechanismy jsou pozorovány i při příznivém průběhu hepatitidy B, s jedinou zvláštností, že se všechny realizují na kvalitativně odlišné úrovni. Na rozdíl od případů masivní nekrózy jater je při příznivém průběhu onemocnění počet infikovaných hepatocytů, a tedy i zóna imunopatologické cytolýzy, menší, procesy lipidové peroxidace nejsou tak výrazně zesíleny, aktivace kyselých hydroláz vede pouze k omezené autolýze s nevýznamným uvolňováním autoantigenů, a tedy bez masivní autoagrese, tj. všechny fáze patogeneze při příznivém průběhu probíhají v rámci zachované strukturní organizace jaterního parenchymu a jsou omezeny obrannými systémy (antioxidanty, inhibitory atd.), a proto nemají tak destruktivní účinek.
Příčiny intoxikačních příznaků u virové hepatitidy nebyly dosud plně prozkoumány. Návrh rozlišovat mezi tzv. primární neboli virovou intoxikací a sekundární (výměnnou neboli metabolickou) lze považovat za pozitivní, i když to neodhaluje hluboký mechanismus vzniku celkového toxického syndromu. Zaprvé, viry hepatitidy nemají toxické vlastnosti a zadruhé, koncentrace mnoha metabolitů ne vždy koreluje se závažností onemocnění a stupněm projevů toxikózních příznaků. Je také známo, že koncentrace virových antigenů striktně nekoreluje se závažností intoxikace. Naopak, se zvyšující se závažností onemocnění, a tedy i se zvyšujícím se stupněm toxikózy, koncentrace HBsAg klesá a je nejnižší u maligních forem v době nástupu hlubokého jaterního kómatu. Současně frekvence detekce a titry specifických antivirových protilátek přímo závisí na závažnosti onemocnění.
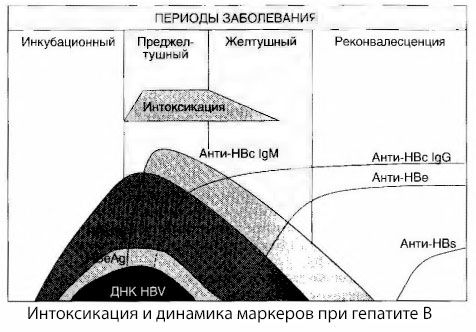
Intoxikace se neobjevuje v okamžiku registrace virových antigenů, ale během doby cirkulace antivirových protilátek třídy IgM proti kravskému antigenu a antigenu systému E v krvi. Navíc u těžkých a zejména maligních forem má významná část pacientů v krvi dokonce anti-HBs, což se u mírných a středně těžkých forem onemocnění obvykle nikdy nepozoruje.
Prezentované údaje nám umožňují dojít k závěru, že syndrom toxikózy u virové hepatitidy, a zejména hepatitidy B, nevzniká v důsledku výskytu virových antigenů v krvi, ale je důsledkem interakce virových antigenů s antivirovými protilátkami třídy IgM. Výsledkem takové interakce, jak je známo, je tvorba imunitních komplexů a případně i aktivních toxických látek.
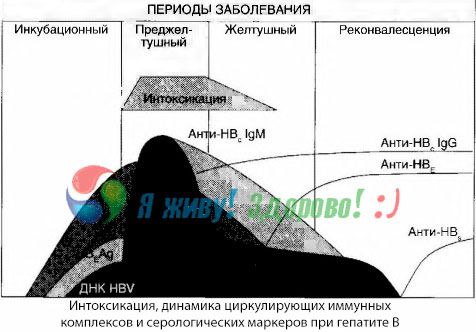
Příznaky intoxikace vznikají v okamžiku výskytu imunitních komplexů ve volném oběhu, ale následně se taková korelace nepozoruje.
Částečné vysvětlení lze nalézt ve studiu složení imunitních komplexů. U pacientů s těžkými formami cirkulují v krvi převážně středně velké komplexy a v jejich složení na vrcholu toxického syndromu převládají protilátky třídy IgG, zatímco v období poklesu klinických projevů a rekonvalescence se komplexy zvětšují a v jejich složení začínají převažovat protilátky třídy IgG.
Prezentované údaje se týkají mechanismů rozvoje toxického syndromu v počátečním období onemocnění, ale u toxikózy probíhající na vrcholu klinických projevů mají pouze částečný význam, a to zejména při rozvoji jaterního kómatu.
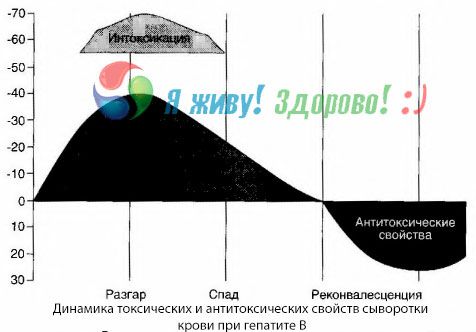
Metoda krevních kultur ukázala, že u hepatitidy B se v krvi neustále hromadí toxiny, které se uvolňují z poškozené, rozpadající se jaterní tkáně. Koncentrace těchto toxinů je úměrná závažnosti onemocnění, jsou proteinové povahy.
Během období rekonvalescence se v krvi objevují protilátky proti tomuto toxinu, ale v případě jaterního kómatu se koncentrace toxinu v krvi prudce zvyšuje a protilátky se v krvi neprokazují.
Patomorfologie hepatitidy B
Na základě povahy morfologických změn se rozlišují tři formy akutní hepatitidy B:
- cyklický tvar,
- masivní nekróza jater;
- cholestatická pericholangiolytická hepatitida.
U cyklické formy hepatitidy B jsou dystrofické, zánětlivé a proliferativní změny výraznější ve středu lalůčků, zatímco u hepatitidy A jsou lokalizovány podél periferie lalůčku a šíří se do středu. Tyto rozdíly jsou vysvětleny různými cestami průniku viru do jaterního parenchymu. Virus hepatitidy A vstupuje do jater portální žílou a šíří se do středu lalůčků, virus hepatitidy B proniká jaterní tepnou a kapilárními větvemi, které rovnoměrně zásobují všechny lalůčky, až do jejich středu.
Stupeň poškození jaterního parenchymu ve většině případů odpovídá závažnosti klinických projevů onemocnění. U mírných forem se obvykle pozoruje fokální nekróza hepatocytů a u středně těžkých a těžkých forem zonální nekróza (s tendencí ke slučování a tvorbě můstkovité nekrózy u těžkých forem onemocnění).
Největší morfologické změny v parenchymu jsou pozorovány na vrcholu klinických projevů, což obvykle shoduje s první dekádou onemocnění. Během 2. a zejména 3. dekády se regenerační procesy zintenzivňují. V tomto období nekrobiotické změny téměř úplně mizí a začínají převládat procesy buněčné infiltrace s pomalou následnou obnovou struktury hepatocelulárních plotének. K úplné obnově struktury a funkce jaterního parenchymu však dochází pouze 3–6 měsíců po nástupu onemocnění a ne u všech pacientů.
Generalizovaná povaha infekce u hepatitidy B je potvrzena detekcí HBsAg nejen v hepatocytech, ale také v ledvinách, plicích, slezině, slinivce břišní, buňkách kostní dřeně atd.
Cholestatická (pericholangiolytická) hepatitida je zvláštní formou onemocnění, u které se největší morfologické změny vyskytují na straně intrahepatálních žlučovodů s obrazem cholangiolitidy a pericholangiolitidy. U cholestatické formy dochází k cholestáze s dilatací žlučových kapilár se stází žluči v nich, s proliferací cholangioly a buněčnými infiltráty kolem nich. Jaterní buňky jsou u této formy hepatitidy postiženy nevýznamně. Klinicky je onemocnění charakterizováno vleklým průběhem s prodlouženou žloutenkou. Bylo prokázáno, že příčinou takového zvláštního průběhu onemocnění je převládající účinek viru na stěny cholangioly s nevýznamným vlivem na hepatocyty.

