Lékařský expert článku
Nové publikace
Ovarium
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
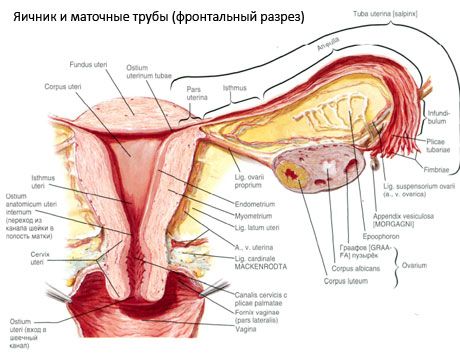
Vaječník (ovarium; řecky oophoron) je párový orgán, ženská reprodukční žláza, umístěná v pánevní dutině za širokým vazem dělohy. Ve vaječnících se vyvíjejí a dozrávají ženské reprodukční buňky (vajíčka) a tvoří se ženské pohlavní hormony, které vstupují do krve a lymfy. Vaječník má vejčitý tvar, poněkud zploštělý v předozadní směru. Barva vaječníku je narůžovělá. Na povrchu vaječníku ženy, která rodila, jsou viditelné prohlubně a jizvy - stopy ovulace a přeměny žlutého tělíska. Vaječník váží 5-8 g. Rozměry vaječníku jsou: délka 2,5-5,5 cm, šířka 1,5-3,0 cm, tloušťka - až 2 cm. Vaječník má dva volné povrchy: mediální povrch (facies medialis), obrácený do pánevní dutiny, částečně krytý vejcovodem, a boční povrch (facies lateralis), přiléhající k boční stěně pánve, k mírně vyjádřenému prohlubni - jamce vaječníku. Tato jamka se nachází v úhlu mezi zevními iliakálními cévami pokrytými nahoře peritoneem a dole děložní a obturátorovou tepnou. Za vaječníkem prochází retroperitoneálně shora dolů močovod odpovídající strany.
Povrchy vaječníku přecházejí do konvexního volného (zadního) okraje (margo liber), vpředu do mezenterického okraje (margo mesovaricus), připojeného krátkým záhybem pobřišnice (mezenteria vaječníku) k zadnímu cípu širokého vazu dělohy. Na tomto předním okraji orgánu se nachází rýhovaná prohlubeň - hilum vaječníku (hilum ovarii), kterým do vaječníku vstupují tepny a nervy a vystupují žíly a lymfatické cévy. Vaječník má také dva konce: zaoblený horní tubulární konec (extremitas tubaria), obrácený k vejcovodu, a dolní děložní konec (extremitas utenna), spojený s dělohou ovariálním vazem (lig. ovarii proprium). Tento vaz, ve formě kulatého provazce o tloušťce asi 6 mm, vede od děložního konce vaječníku k bočnímu úhlu dělohy, který se nachází mezi dvěma listy širokého vazu dělohy. Vazivový aparát vaječníku zahrnuje také vazivo zavěšující vaječník (lig.suspensorium ovarii), což je záhyb pobřišnice, který probíhá od stěny malé pánve k vaječníku a uvnitř obsahuje ovariální cévy a svazky vláknitých vláken. Vaječník je upevněn krátkým mesenteriem (mesovarium), což je duplikát pobřišnice, který probíhá od zadního cípu širokého vazu dělohy k mezenterickému okraji vaječníku. Samotné vaječníky nejsou pobřišnicí pokryty. Největší ovariální lem vejcovodu je připojen k tubulárnímu konci vaječníku. Topografie vaječníku závisí na poloze dělohy, její velikosti (během těhotenství). Vaječníky jsou velmi pohyblivé orgány dutiny malé pánve.
Cévy a nervy vaječníku
Krevní zásobení vaječníků je zajištěno aa. et vv. ovaricae et uterinae. Obě ovariální tepny (aa. ovaricae dextra et sinistra) vycházejí z předního povrchu aorty těsně pod renálními tepnami; pravá obvykle vychází z aorty a levá z renální tepny. Každá ovariální tepna směřuje dolů a laterálně podél předního povrchu musculus psoas major (velkého bederního svalu), protíná vpředu močovod (od nějž se odvíjí), zevní iliakální cévy, hraniční linii a vstupuje do pánevní dutiny, kde se nachází v závěsném vazu vaječníku. V mediálním směru prochází ovariální tepna mezi listy širokého vazu dělohy pod vejcovodem, od nějž se odvíjí, a poté do mesenteria vaječníku, kde vstupuje do hilu vaječníku.
Větve ovariální tepny se široce anastomují s ovariálními větvemi děložní tepny. Žilní odtok z vaječníků je realizován primárně do ovariálního žilního plexu, který se nachází v oblasti ovariálního hilu. Odtud probíhá odtok krve dvěma směry: děložními a ovariálními žilami. Pravá ovariální žíla má chlopně a ústí do dolní duté žíly. Levá ovariální žíla ústí do levé ledvinové žíly, ačkoliv nemá žádné chlopně.
Lymfatická drenáž z vaječníků probíhá lymfatickými cévami, obzvláště hojně v oblasti orgánových bran, kde se rozlišuje subovariální lymfatický plexus. Poté je lymfa odváděna podél ovariálních lymfatických cév do paraaortálních lymfatických uzlin.
Inervace vaječníků
Sympatický - zajištěn postgangliovými vlákny z celiakie (solárního), horního mezenterického a hypogastrického plexu; parasympatický - viscerálními sakrálními nervy.
Struktura vaječníku
Povrch vaječníku je pokryt jednovrstvým zárodečným epitelem. Pod ním leží hustý proteinový obal pojivové tkáně (tunica albuginea). Pojivová tkáň vaječníku tvoří jeho stroma (stroma ovarii), bohaté na elastická vlákna. Hmota vaječníku, jeho parenchym, se dělí na vnější a vnitřní vrstvu. Vnitřní vrstva, nacházející se uprostřed vaječníku, blíže k jeho bráně, se nazývá dřeň (medulla ovarii). V této vrstvě, v řídké pojivové tkáni, se nachází četné krevní a lymfatické cévy a nervy. Vnější vrstva vaječníku - kůra (cortex ovarii) je hustší. Obsahuje hodně pojivové tkáně, ve které se nacházejí zrající primární ovariální folikuly (folliculi ovarici primarii), sekundární (vezikulární) folikuly (folliculi ovarici secundarii, s.vesiculosi), dále zralé folikuly, Graafovy folikuly (folliculi ovarici maturis), a také žlutá a atretická tělíska.
Každý folikul obsahuje samičí reprodukční vajíčko neboli oocyt (ovocytus). Vajíčko má průměr až 150 µm, je kulaté, obsahuje jádro, velké množství cytoplazmy, která kromě buněčných organel obsahuje bílkovinno-lipidové inkluze (žloutek) a glykogen, nezbytné pro výživu vajíčka. Vajíčko obvykle spotřebuje zásobu živin do 12–24 hodin po ovulaci. Pokud k oplodnění nedojde, vajíčko odumírá.
Lidské vajíčko je pokryté dvěma membránami. Uvnitř se nachází cytolemma, což je cytoplazmatická membrána vajíčka. Vně cytolemmy je vrstva tzv. folikulárních buněk, které vajíčko chrání a plní hormonální funkci – vylučují estrogeny.
Fyziologickou polohu dělohy, vejcovodů a vaječníků zajišťují závěsné, fixační a podpůrné ústrojí, které spojuje pobřišnici, vazy a pánevní tkáň. Závěsné ústrojí je reprezentováno párovými útvary, zahrnuje kulaté a široké vazy dělohy, vlastní vazy a závěsné vazy vaječníků. Široké vazy dělohy, vlastní a závěsné vazy vaječníků drží dělohu ve střední poloze. Kulaté vazy táhnou fundus dělohy dopředu a zajišťují jeho fyziologický sklon.
Fixační (kotvicí) aparát zajišťuje polohu dělohy ve středu malé pánve a prakticky znemožňuje její posun do stran, tam a zpět. Protože však vazivový aparát odstupuje od dělohy v její spodní části, jsou možné náklony dělohy v různých směrech. Fixační aparát zahrnuje vazy umístěné v řídké tkáni pánve a sahající od spodní části dělohy k boční, přední a zadní stěně pánve: sakromagické, kardinální, uterovezikální a vezikopubické vazy.
Kromě mesovaria se rozlišují následující ovariální vazy:
- závěsný vaz vaječníku, dříve označovaný jako infundibulopelvický vaz. Je to záhyb pobřišnice s procházejícími cévami (a. et v. ovarica) a lymfatickými cévami a nervy vaječníku, natažený mezi boční stěnou pánve, bederní fascií (v oblasti rozdělení společné kyčelní tepny na zevní a vnitřní) a horním (tubálním) koncem vaječníku;
- Vlastní vaz vaječníku prochází mezi listy širokého děložního vazu, blíže k zadnímu listu, a spojuje spodní konec vaječníku s bočním okrajem dělohy. Vlastní vaz vaječníku je připevněn k děloze mezi začátkem vejcovodu a kulatým vazem, za ním a nad ním. V tloušťce vazu procházejí rr. ovarii, což jsou koncové větve děložní tepny;
- appendikulárně-vaječníkový vaz Vaz se táhne od mezenteria slepého střeva k pravému vaječníku nebo širokému vazu dělohy ve formě záhybu pobřišnice. Vaz je nestálý a pozoruje se u 1/2 - 1/3 žen.
Podpůrný aparát je reprezentován svaly a fascií pánevního dna, rozdělenými na spodní, střední a horní (vnitřní) vrstvu.
Nejsilnější je horní (vnitřní) svalová vrstva, kterou představuje párový sval, který zvedá řitní otvor. Skládá se ze svalových svazků, které se vějířovitě rozprostírají od kostrče k pánevním kostem ve třech směrech (pubococcygeus, iliococcygeus a ischiococcygeus). Tato vrstva svalů se také nazývá pánevní bránice.
Střední vrstva svalů se nachází mezi symfýzou, stydkou a sedací kostí. Střední vrstva svalů - urogenitální bránice - zaujímá přední polovinu pánevního vývodu, kterým prochází močová trubice a pochva. V přední části mezi jejími vrstvami se nacházejí svalové svazky, které tvoří zevní svěrač močové trubice, v zadní části jsou svalové svazky, které jdou v příčném směru - hluboký příčný sval hráze.
Spodní (vnější) vrstva svalů pánevního dna se skládá z povrchových svalů, jejichž tvar připomíná číslo 8. Patří mezi ně bulbokavernózní sval, ischiokavernózní sval, zevní anální svěrač a povrchový příčný perineální sval.
Ontogeneze vaječníků
Proces růstu a atrézie folikulů začíná ve 20. týdnu těhotenství a v době porodu zůstávají ve vaječnících dívky až 2 miliony oocytů. Do menarché se jejich počet snižuje na 300 tisíc. Během celého reprodukčního období nedosáhne zralosti a ovulace více než 500 folikulů. Počáteční růst folikulů nezávisí na stimulaci FSH, je omezený a k atrézii dochází rychle. Předpokládá se, že místo steroidních hormonů jsou hlavním regulátorem růstu a atrézie primárních folikulů lokální autokrinní/parakrinní peptidy. Předpokládá se, že proces růstu a atrézie folikulů není přerušen žádnými fyziologickými procesy. Tento proces pokračuje ve všech věkových kategoriích, včetně nitroděložního období a menopauzy, a je přerušen těhotenstvím, ovulací a anovulací. Mechanismus, který spouští růst folikulů a jejich počet v každém konkrétním cyklu, je stále nejasný.
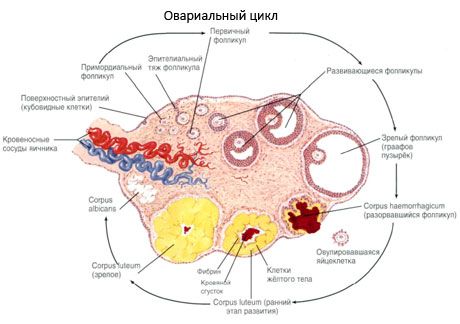
Během svého vývoje prochází folikul několika vývojovými fázemi. Primordiální zárodečné buňky pocházejí z endodermu žloutkového vaku, allantois, a migrují do genitální oblasti embrya v 5.–6. týdnu těhotenství. V důsledku rychlého mitotického dělení, které pokračuje od 6.–8. týdne do 16.–20. týdne těhotenství, se ve vaječnících embrya vytvoří až 6–7 milionů oocytů, obklopených tenkou vrstvou granulózních buněk.
Preantrální folikul - oocyt je obklopen membránou (Zona pellucida). Granulosové buňky obklopující oocyt začínají proliferovat, jejich růst závisí na gonadotropinech a koreluje s hladinou estrogenů. Granulosové buňky jsou cílem FSH. Ve stádiu preantrálního folikulu jsou granulosové buňky schopny syntetizovat tři třídy steroidů: převážně indukuje aktivitu aromatázy, hlavního enzymu, který přeměňuje androgeny na estradiol. Předpokládá se, že estradiol je schopen zvyšovat počet vlastních receptorů a vyvíjet tak přímý mitogenní účinek na granulosové buňky nezávisle na FSH. Je považován za parakrinní faktor, který zesiluje účinky FSH, včetně aktivace aromatizačních procesů.
Receptory FSH se objevují na membránách granulózních buněk, jakmile začne růst folikulu. Snížení nebo zvýšení FSH vede ke změně počtu jeho receptorů. Toto působení FSH je modulováno růstovými faktory. FSH působí prostřednictvím G-proteinu, adenylátcyklázového systému, ačkoli steroidogeneze ve folikulu je regulována hlavně FSH, do tohoto procesu se zapojuje mnoho faktorů: iontové kanály, tyrozinkinázové receptory, fosfolipázový systém sekundárních poslů.
Role androgenů v raném vývoji folikulů je složitá. Granulosové buňky mají androgenní receptory. Ty jsou nejen substrátem pro aromatizaci na estrogeny indukovanou FSH, ale mohou také aromatizaci při nízkých koncentracích zesílit. Když se hladiny androgenů zvýší, preantrální granulosové buňky přednostně nevolí cestu aromatizace na estrogeny, ale jednodušší cestu androgenů prostřednictvím 5α-reduktázy, aby se přeměnily na androgen, který nelze přeměnit na estrogen, čímž inhibují aktivitu aromatázy. Tento proces také inhibuje tvorbu receptorů FSH a LH, čímž zastavuje vývoj folikulů.
Proces aromatizace, folikul s vysokou hladinou androgenů prochází atrézií. Růst a vývoj folikulu závisí na jeho schopnosti přeměňovat androgeny na estrogeny.
V přítomnosti FSH budou dominantní látkou folikulární tekutiny estrogeny. V nepřítomnosti FSH - androgeny. LH ve folikulární tekutině normálně chybí až do poloviny cyklu. Jakmile se hladina LH zvýší, mitotická aktivita granulózních buněk se sníží, objeví se degenerativní změny a hladina androgenů ve folikulu se zvýší. Hladina steroidů ve folikulární tekutině je vyšší než v plazmě a odráží funkční aktivitu ovariálních buněk: granulózních a thekálních buněk. Pokud je jediným cílem FSH granulózní buňky, pak má LH mnoho cílů - thekální buňky, stromální a luteinové buňky a granulózní buňky. Schopnost steroidogeneze mají jak granulózní, tak thekální buňky, ale v granulózních buňkách převládá aromatázová aktivita.
V reakci na LH produkují thekální buňky androgeny, které jsou následně granulózními buňkami přeměněny na estrogeny prostřednictvím aromatizace indukované FSH.
Jak folikul roste, thekální buňky začínají exprimovat geny pro LH receptory, P450 sec a 3beta-hydroxysteroid dehydrogenázu, inzulínu podobný růstový faktor (IGF-1) synergicky s LH zvyšuje genovou expresi, ale nestimuluje steroidogenezi.
Ovariální steroidogeneze je vždy závislá na LH. Jak folikul roste, thekální buňky exprimují enzym P450c17, který tvoří androgen z cholesterolu. Granulosové buňky tento enzym nemají a jsou závislé na thekálních buňkách, aby produkovaly estrogeny z androgenů. Na rozdíl od steroidogeneze je folikulogeneze závislá na FSH. Jak folikul roste a hladiny estrogenu se zvyšují, aktivuje se mechanismus zpětné vazby - produkce FSH je inhibována, což následně vede ke snížení aktivity aromatázy folikulu a v konečném důsledku k atrézii folikulu apoptózou (programovaná buněčná smrt).
Mechanismus zpětné vazby estrogenů a FSH inhibuje vývoj folikulů, které začaly růst, ale ne dominantního folikulu. Dominantní folikul obsahuje více receptorů FSH, které podporují proliferaci granulózních buněk a aromatizaci androgenů na estrogeny. Kromě toho parakrinní a autokrinní dráha působí jako důležitý koordinátor vývoje antrálního folikulu.
Autokrinní/parakrinní regulátor se skládá z peptidů (inhibin, aktivin, folistatin), které jsou syntetizovány granulózními buňkami v reakci na FSH a vstupují do folikulární tekutiny. Inhibin snižuje sekreci FSH; aktivin stimuluje uvolňování FSH z hypofýzy a zvyšuje účinek FSH ve vaječníku; folistatin potlačuje aktivitu FSH, pravděpodobně vazbou na aktivin. Po ovulaci a vývoji žlutého tělíska je inhibin pod kontrolou LH.
Růst a diferenciaci ovariálních buněk ovlivňují inzulinu podobné růstové faktory (IGE). IGF-1 působí na granulosové buňky a způsobuje zvýšení hladiny cyklického adenosinmonofosfátu (cAMP), progesteronu, oxytocinu, proteoglykanu a inhibinu.
IGF-1 působí na thekální buňky a způsobuje zvýšenou produkci androgenů. Thekální buňky zase produkují faktor nekrózy nádorů (TNF) a epidermální růstový faktor (EGF), které jsou také regulovány FSH.
EGF stimuluje proliferaci granulózních buněk. IGF-2 je hlavním růstovým faktorem ve folikulární tekutině a nacházejí se v ní také IGF-1, TNF-a, TNF-3 a EGF.
Zdá se, že narušení parakrinní a/nebo autokrinní regulace ovariálních funkcí hraje roli v poruchách ovulace a ve vývoji polycystických vaječníků.
S růstem antrálního folikulu se zvyšuje obsah estrogenů ve folikulární tekutině. Na vrcholu jejich nárůstu se na granulózních buňkách objevují receptory pro LH, dochází k luteinizaci granulózních buněk a zvyšuje se produkce progesteronu. V preovulačním období tedy zvýšená produkce estrogenů způsobuje výskyt LH receptorů, LH zase způsobuje luteinizaci granulózních buněk a produkci progesteronu. Zvýšení progesteronu snižuje hladinu estrogenů, což zřejmě způsobuje druhý vrchol FSH uprostřed cyklu.
K ovulaci dochází pravděpodobně 10–12 hodin po vrcholu LH a 24–36 hodin po vrcholu estradiolu. Předpokládá se, že LH stimuluje redukční dělení oocytů, luteinizaci granulózních buněk a syntézu progesteronu a prostaglandinů ve folikulu.
Progesteron zvyšuje aktivitu proteolytických enzymů, které se spolu s prostaglandinem podílejí na prasknutí stěny folikulu. Progesteronem indukovaný vrchol FSH umožňuje oocytu opustit folikul přeměnou plazminogenu na proteolytický enzym plazmin a poskytuje dostatečný počet LH receptorů pro normální vývoj luteální fáze.
Do 3 dnů po ovulaci se granulózní buňky zvětšují a objevují se v nich charakteristické vakuoly naplněné pigmentem luteinem. Thekální luteální buňky se diferencují z theky a stromatu a stávají se součástí žlutého tělíska. Kapiláry pronikající žlutým tělískem se pod vlivem faktorů angiogeneze vyvíjejí velmi rychle a se zlepšenou vaskularizací se zvyšuje produkce progesteronu a estrogenů. Aktivita steroidogeneze a délka života žlutého tělíska jsou určeny hladinou LH. Žluté tělísko není homogenní buněčný útvar. Kromě 2 typů luteálních buněk obsahuje endotelové buňky, makrofágy, fibroblasty atd. Velké luteální buňky produkují peptidy (relaxin, oxytocin) a jsou aktivnější ve steroidogenezi s větší aktivitou aromatázy a větší syntézou progesteronu než malé buňky.
Vrchol progesteronu nastává 8. den po vrcholu LH. Je třeba poznamenat, že progesteron a estradiol jsou v luteální fázi vylučovány epizodicky v korelaci s pulzatilní produkcí LH. S tvorbou žlutého tělíska přechází kontrola produkce inhibinu z FSH na LH. Inhibin se zvyšuje se zvyšujícím se estradiolem před vrcholem LH a nadále se zvyšuje i po vrcholu LH, i když hladiny estrogenu klesají. Ačkoli jsou inhibin a estradiol vylučovány granulózními buňkami, jsou regulovány různými cestami. Pokles inhibinu na konci luteální fáze přispívá ke zvýšení FSH v dalším cyklu.
Žluté tělísko se velmi rychle zmenšuje - 9.-11. den po ovulaci.
Mechanismus degenerace není jasný a nesouvisí s luteolytickou rolí estrogenů ani s mechanismem souvisejícím s receptory, jak je pozorováno v endometriu. Existuje i jiné vysvětlení role estrogenů produkovaných žlutým tělískem (corpus luteum). Je známo, že estrogeny jsou nezbytné pro syntézu progesteronových receptorů v endometriu. Estrogeny luteální fáze jsou pravděpodobně nezbytné pro změny endometria související s progesteronem po ovulaci. Nedostatečný vývoj progesteronových receptorů v důsledku nedostatečných hladin estrogenů je pravděpodobně dalším mechanismem neplodnosti a časných těhotenských ztrát, což je další forma deficitu luteální fáze. Předpokládá se, že délka života žlutého tělíska je stanovena v době ovulace. A pokud není v důsledku těhotenství podporováno lidským choriovým gonadotropinem, jistě dojde k jeho regresi. Regrese žlutého tělíska tedy vede ke snížení hladin estradiolu, progesteronu a inhibinu. Snížení hladiny inhibinu odstraňuje jeho supresivní účinek na FSH; Pokles estradiolu a progesteronu umožňuje velmi rychlé obnovení sekrece GnRH a odstranění mechanismu zpětné vazby z hypofýzy. Pokles inhibinu a estradiolu spolu se zvýšením GnRH vede ke vzniku FSH nad LH. Zvýšení FSH vede k růstu folikulů s následnou selekcí dominantního folikulu a pokud k otěhotnění nedojde, začíná nový cyklus. Steroidní hormony hrají hlavní roli v reprodukční biologii a obecné fyziologii. Určují lidský fenotyp, ovlivňují kardiovaskulární systém, metabolismus kostí, kůži, celkovou pohodu a hrají klíčovou roli v těhotenství. Působení steroidních hormonů odráží intracelulární a genetické mechanismy, které jsou nezbytné k přenosu extracelulárního signálu do buněčného jádra a vyvolání fyziologické reakce.
Estrogeny difúzně pronikají buněčnou membránou a vážou se na receptory umístěné v buněčném jádře. Komplex receptor-steroid se poté váže na DNA. V cílových buňkách tyto interakce vedou k genové expresi, syntéze proteinů a specifickým funkcím buněk a tkání.


 [
[