Lékařský expert článku
Nové publikace
Obvyklý potrat - příčiny
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
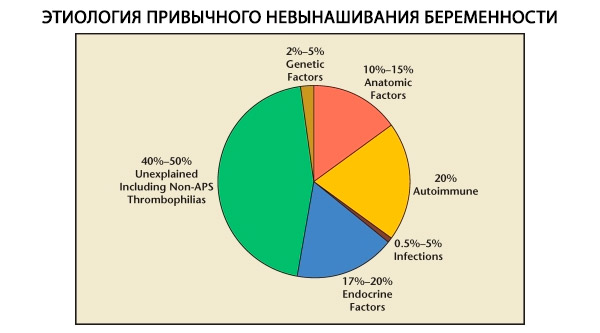
Ve struktuře habituálních potratů se rozlišují genetické, anatomické, endokrinní, imunologické a infekční faktory. Po vyloučení všech výše uvedených příčin zůstává skupina pacientek, u kterých je původ habituálního potratu nejasný (idiopatické potraty). Podle C. Coulama a kol. (1996) je 80 % idiopatických potratů založeno na nerozpoznaných poruchách imunity.
Neexistují přesvědčivé důkazy o tom, že endometrióza způsobuje opakované potraty, nebo že medikamentózní nebo chirurgická léčba endometriózy snižuje výskyt opakovaných potratů.
Podle současných konceptů, kromě genetických a částečně infekčních příčin vedoucích ke vzniku abnormálního embrya, spočívá realizace škodlivého účinku dalších faktorů (anatomických, endokrinních, imunologických) ve vytvoření nepříznivého pozadí pro vývoj geneticky kompletního oplodněného vajíčka, což vede k vyčerpání rezervní kapacity chorionu a zastavení vývoje (embryogeneze). Kritická období v prvním trimestru těhotenství jsou rozpoznána jako 6-8 týdnů (smrt embrya) a 10-12 týdnů (vyloučení oplodněného vajíčka).
 [ 1 ]
[ 1 ]
Genetické příčiny habituálního potratu
Genetické faktory tvoří 3–6 % příčin habituálních potratů. U sporadických ukončení těhotenství v prvním trimestru má asi 50 % potratů chromozomální abnormality. Většina z nich (95 %) se týká změn v počtu chromozomů - monosomie (ztráta jednoho chromozomu), trisomie (přítomnost dalšího chromozomu), které jsou důsledkem chyb v meióze, a také polyploidie (zvýšení chromozomálního složení o plnou haploidní sadu), ke které dochází při oplodnění vajíčka dvěma nebo více spermiemi. U sporadických potratů se nejčastěji vyskytuje trisomie - 60 % všech mutací (nejčastěji na chromozomu 16, dále 13, 18, 21, 22), na druhém místě co do četnosti je Šereshevského-Turnerův syndrom (chromozom 45 X0) - 20 %, zbývajících 15 % připadá na polyploidii (zejména triploidii).
V případě změny počtu chromozomů při potratu vyšetření karyotypu rodičů nejčastěji neodhalí žádnou patologii a pravděpodobnost chromozomálního onemocnění plodu během následného těhotenství je 1 %. Naproti tomu při vyšetřování potratů u párů s habituálním potratem jsou strukturální změny chromozomů (intra- a interchromozomální) pozorovány ve 3–6 % případů. Při vyšetření karyotypu rodičů se v 7 % případů nacházejí vyvážené chromozomální přeskupení. Nejčastěji se jedná o reciproční translokace, kdy se segment jednoho chromozomu nachází na místě jiného segmentu nehomologního chromozomu, dále o mozaiku pohlavních chromozomů, inverzi a detekci chromozomů ve tvaru kruhu. V případě přítomnosti takových přeskupení u jednoho z manželů jsou procesy párování a separace chromozomů během meiózy narušeny, což má za následek ztrátu (deleci) nebo zdvojení (duplikaci) chromozomálních úseků v gametách. To má za následek tzv. nevyvážené chromozomální přeskupení, kdy je embryo buď neživotaschopné, nebo slouží jako nositel závažné chromozomální patologie. Pravděpodobnost narození dítěte s nevyváženými chromozomálními abnormalitami v přítomnosti vyvážených chromozomálních přeskupení v karyotypu jednoho z rodičů je 1–15 %. Rozdíly v datech souvisejí s povahou přeskupení, velikostí zúčastněných segmentů, pohlavím nositele a rodinnou anamnézou.
Diagnostika
Anamnéza
- Dědičná onemocnění u členů rodiny.
- Přítomnost vrozených anomálií v rodině.
- Narození dětí s mentální retardací.
- Přítomnost neplodnosti a/nebo potratu neznámého původu u manželského páru nebo u příbuzných.
- Přítomnost nejasných případů perinatální úmrtnosti.
Speciální výzkumné metody
- Studium karyotypu rodičů je zvláště indikováno u manželských párů při narození novorozence s vývojovými vadami a také s anamnézou potratu, stejně jako v případech habituálního potratu v raných fázích těhotenství.
- Cytogenetická analýza potratů v případech mrtvě narozeného dítěte nebo novorozenecké úmrtnosti.
Indikace pro konzultaci s dalšími specialisty
Pokud se u rodičů zjistí změny v karyotypu, je nutná konzultace s genetikem, aby se posoudil stupeň rizika narození dítěte s patologií, nebo v případě potřeby se rozhodlo o otázce darování vajíčka nebo spermií.
Další léčba pacienta
Pokud má manželský pár patologický karyotyp, a to i u jednoho z rodičů, doporučuje se provést prenatální diagnostiku během těhotenství - choriovou biopsii nebo amniocentézu - kvůli vysokému riziku vývojových poruch u plodu.
Anatomické příčiny habituálního potratu
Mezi anatomické příčiny habituálního potratu patří:
- vrozené anomálie ve vývoji dělohy (úplné zdvojení dělohy; dvourohá, sedlovitá, jednorohá děloha; částečná nebo úplná nitroděložní přepážka);
- získané anatomické vady;
- intrauterinní srůsty (Ashermanův syndrom);
- submukózní děložní myomy;
- isthmicko-cervikální insuficience.
Četnost anatomických anomálií u pacientek s habituálním potratem se pohybuje v rozmezí 10 až 16 %. Četnost výskytu malformací dělohy, které mohou vést k potratu (ale nikoli k neplodnosti), ve vztahu ke všem malformacím dělohy je následující: dvourohá děloha - 37 %, sedlovitá děloha - 15 %, nitroděložní přepážka - 22 %, úplné zdvojení dělohy - 11 %, jednorohá děloha - 4,4 %.
Diagnóza habituálního potratu
Anamnéza
V případě anatomické patologie dělohy se častěji pozorují pozdní ukončení těhotenství a předčasné porody, avšak při implantaci na nitroděložní přepážce nebo v blízkosti myomatózního uzlu je možné i předčasné ukončení těhotenství.
Pro isthmicko-cervikální insuficienci je patognomickým příznakem spontánní ukončení těhotenství ve druhém trimestru nebo časný předčasný porod, ke kterému dochází relativně rychle a s malou bolestí.
V případě malformací dělohy je nutné věnovat pozornost anamnestickým indikacím patologie močových cest (často doprovázejícím vrozené anomálie dělohy) a povaze vývoje menstruační funkce (indikace hematometry s funkčním rudimentárním rohem dělohy).
Speciální vyšetřovací metody
- V současné době se hysterosalpingografie provádí k stanovení diagnózy, která umožňuje studovat tvar děložní dutiny, identifikovat přítomnost submukózních myomů, srůstů, sept a určit průchodnost vejcovodů. Pro diagnostiku děložní patologie je racionální provádět hysterosalpingografii v období mezi menstruací a ovulací, tj. v první fázi menstruačního cyklu po ukončení krvácení (7.–9. den cyklu). Pro diagnostiku isthmicko-cervikální insuficience se vyšetření provádí ve druhé fázi menstruačního cyklu (18.–20. den), aby se zjistil stav vnitřního ústí děložního čípku. Před provedením hysterosalpingografie je nutné vyloučit zánětlivá onemocnění pánevních orgánů nebo je léčit.
- Hysteroskopie se v posledních letech rozšířila a stala se zlatým standardem pro diagnostiku nitroděložní patologie. Vzhledem k vyšším nákladům ve srovnání s hysterosalpingografií se však tato metoda používá u žen s indikací nitroděložní patologie na základě předběžných ultrazvukových dat. Hysteroskopii lze použít k vyšetření dutiny děložní, určení povahy nitroděložní patologie a v případě dostupnosti potřebného vybavení (resektoskopu) provést minimálně invazivní chirurgickou léčbu - odstranění srůstů, submukózních myomových uzlin a endometriálních polypů. Při odstraňování nitroděložní přepážky se upřednostňuje hysteroresektoskopie s laparoskopickou kontrolou, která zabraňuje možnosti perforace stěny dělohy.
- Ultrazvuk se provádí v první fázi menstruačního cyklu, což umožňuje předpokládanou diagnózu submukózního děložního myomu, intrauterinních srůstů a ve druhé fázi cyklu - identifikaci intrauterinní přepážky a dvourohé dělohy. Tato metoda má zvláštní význam v raných stádiích těhotenství, kdy je její citlivost v diagnostice těchto stavů 100 % a specificita 80 %. Mimo těhotenství vyžaduje diagnóza další potvrzení jinými metodami.
- Zahraniční autoři poukazují na výhodu sonohysterografie (ultrazvuk s použitím transvaginálního senzoru s předchozím zavedením 0,9% roztoku chloridu sodného do děložní dutiny) oproti hysterosalpingografii, protože umožňuje diferenciální diagnostiku mezi nitroděložní přepážkou a dvourohou dělohou. Pomocí sonohysterografie je možné nejen studovat tvar děložní dutiny, ale také určit konfiguraci fundusu těla dělohy. V naší zemi se tato metoda nerozšířila.
- V některých složitých případech se k ověření diagnózy používá magnetická rezonance pánevních orgánů. Metoda umožňuje získat cenné informace v případě vývojových anomálií dělohy doprovázených atypickým uspořádáním orgánů v pánvi. Magnetická rezonance je důležitá v případě rudimentárního děložního rohu pro rozhodnutí, zda je vhodné jej odstranit. Potřeba odstranit rudimentární děložní roh nastává v případě jeho spojení s vejcovodem a vaječníkem, aby se zabránilo tvorbě a vývoji oplodněného vajíčka v něm. Ukončení těhotenství v případě anatomických anomálií dělohy může být spojeno s neúspěšnou implantací oplodněného vajíčka (na nitroděložní přepážce, v blízkosti submukózního myomového uzlu), nedostatečně vyvinutou vaskularizací a recepcí endometria, těsnými prostorovými vztahy v děložní dutině (například při deformaci dutiny myomovým uzlem), často doprovázenými ICI, a hormonálními poruchami.
Léčba habituálního potratu
Chirurgická léčba
V přítomnosti nitroděložní přepážky, submukózních myomových uzlin a srůstů je nejúčinnější chirurgickou léčbou hysteroresektoskopie. Četnost následných potratů u této skupiny žen po léčbě je 10 % ve srovnání s 90 % před operací. Při porovnání výsledků metroplastiky provedené laparotomií a transcervikální hysteroresektoskopií P. Heinonen (1997) dosáhl výsledků naznačujících menší trauma a větší účinnost hysteroresektoskopie; procento těhotenství vedoucích k narození životaschopných dětí bylo 68 %, respektive 86 %.
Chirurgické odstranění nitroděložní přepážky, srůstů a submukózních myomových uzlin eliminuje potrat v 70–80 % případů. Je však neúčinné u žen s malformacemi dělohy, které měly normální porody s následnými opakovanými potraty. Je pravděpodobné, že v takových případech není anatomický faktor hlavní příčinou a je nutné hledat jiné příčiny potratu.
Bylo prokázáno, že abdominální metroplastika je spojena s významným rizikem pooperační neplodnosti a nezlepšuje prognózu následného těhotenství. Proto je lepší dát přednost hysteroskopii a laparoskopickým operacím.
Léčba drogové závislosti
Účinnost zavedení nitroděložního tělíska, vysokých dávek estrogenních léků, zavedení Foleyho katétru do děložní dutiny po operacích k odstranění srůstů, nitroděložní přepážky nebyla prokázána. Doporučuje se plánovat těhotenství nejdříve 3 měsíce po operaci. Pro zlepšení růstu endometria se provádí cyklická hormonální terapie po dobu 3 menstruačních cyklů [14]. Po dobu 3 měsíců v prvních 14 dnech cyklu se doporučuje užívat lék obsahující 2 mg 17-beta-estradiolu, v následujících 14 dnech - 2 mg 17-beta-estradiolu a 20 mg dydrogesteronu (10 mg dydrogesteronu jako součást kombinovaného léku plus 10 mg dydrogesteronu v samostatné tabletové formě).
Další léčba pacienta
Charakteristiky průběhu těhotenství s bicornuátní dělohou nebo zdvojením dělohy (při přítomnosti 2 děložních dutin):
- v raných stádiích těhotenství se krvácení často vyskytuje z „prázdného“ rohu nebo děložní dutiny v důsledku výrazné deciduální reakce; taktika by v tomto případě měla být konzervativní a spočívat v použití antispasmodik a hemostatických látek;
- hrozba ukončení těhotenství v různých fázích;
- rozvoj isthmicko-cervikální insuficience;
- intrauterinní růstová retardace v důsledku placentární insuficience.
V raných stádiích těhotenství se při krvácení doporučuje klid na lůžku a pololežák, podávání hemostatických, spasmolytických a sedativních léků a terapie gestageny (dydrogesteron v denní dávce 20 až 40 mg) až do 16–18. týdne těhotenství.
Endokrinní příčiny habituálního potratu
Podle různých autorů tvoří endokrinní příčiny potratu 8 až 20 %. Nejvýznamnější z nich jsou deficit luteální fáze (LPD), hypersekrece LH, dysfunkce štítné žlázy a diabetes mellitus.
Závažné onemocnění štítné žlázy nebo diabetes mellitus mohou vést k opakovaným potratům. U kompenzovaného diabetu mellitus se však riziko habituálních potratů neliší od rizika u běžné populace.
Zároveň vysoký výskyt hypotyreózy v populaci vyžaduje screening s měřením hladin TSH. U pacientek s habituálním potratem je insuficience luteální fáze pozorována u 20–60 % případů a ultrazvukové známky polycystických vaječníků u 44–56 %. Podle literatury zůstává vliv jednotlivých hormonálních poruch na vznik komplexu symptomů habituálního potratu kontroverzní. Studie M. Ogasawary a kol. (1997) neodhalily spolehlivé rozdíly ve četnosti ukončení těhotenství s LPI a bez ní u pacientek se dvěma nebo více předchozími potraty v anamnéze, s vyloučením autoimunitních, anatomických a infekčních příčin.
Nedostatečná funkce žlutého tělíska může být výsledkem řady nepříznivých faktorů:
- poruchy sekrece FSH a LH v první fázi menstruačního cyklu;
- předčasný nebo naopak příliš pozdní vrchol uvolňování LH;
- hypoestrogenismus v důsledku nedostatečné folikulogeneze. Všechny tyto stavy nelze korigovat substituční terapií gestagenními léky v postovulačním období. Prospektivní studie provedené L. Regan et al. prokázaly významný nárůst frekvence potratů u pacientek s hypersekrecí LH 8. den menstruačního cyklu ve srovnání s ženami s normálními hladinami LH v krvi (65 %, respektive 12 % potratů). Škodlivý účinek předčasného vzestupu LH je spojen s předčasným obnovením druhého meiotického dělení a ovulace nezralého vajíčka, stejně jako s indukcí produkce androgenů thekálními buňkami spolu se zhoršenou recepcí endometria pod vlivem gestagenní insuficience. Předběžné snížení preovulačních hladin LH agonisty gonadotropin uvolňujícího hormonu však bez dalších opatření zaměřených na prodloužení následného těhotenství neposkytuje očekávané snížení frekvence potratů.
Zlatým standardem pro diagnostiku NLF je histologické vyšetření materiálu získaného z biopsie endometria ve druhé fázi cyklu během 2 menstruačních cyklů.
Diagnóza dalších příčin ovulační dysfunkce, jako je hyperprolaktinémie, hypotyreóza, funkční nadbytek androgenů (vaječníků nebo nadledvin), musí být doprovázena předepsáním vhodné léčby.
Diagnostika
Anamnéza a fyzikální vyšetření
- Anamnéza. Faktory, které je třeba zvážit: pozdní menstruace, nepravidelný menstruační cyklus (oligomenorea, amenorea, náhlé přibírání na váze, úbytek hmotnosti, neplodnost, habituální časné potraty).
- Vyšetření: typ postavy, výška, tělesná hmotnost, hirsutismus, závažnost sekundárních pohlavních znaků, přítomnost strií, vyšetření mléčných žláz na galaktoreu.
- Funkční diagnostické testy: měření rektální teploty během 3 menstruačních cyklů.
Speciální výzkumné metody
- Hormonální studie:
- v 1. fázi menstruačního cyklu (7.–8. den) – stanovení obsahu FSH, LH, prolaktinu, TSH, testosteronu, 17-hydroxyprogesteronu (17-OP), DHEAS;
- ve 2. fázi menstruačního cyklu (21–22 dní) – stanovení obsahu progesteronu (normativní ukazatele hladin progesteronu jsou velmi variabilní, metodu nelze použít bez zohlednění dalších faktorů).
- Ultrazvuk:
- v 1. fázi menstruačního cyklu (5.–7. den) – diagnóza endometriální patologie, polycystických vaječníků;
- ve 2. fázi menstruačního cyklu (20–21 dní) – měření tloušťky endometria (normální 10–11 mm, koreluje s obsahem progesteronu).
- Biopsie endometria k ověření NLF se provádí 2 dny před očekávanou menstruací (26. den při 28denním cyklu). Tato metoda se používá v případech, kdy je diagnóza nejasná. Pro studium změn endometria v tzv. období „implantačního okna“ se biopsie provádí 6. den po ovulaci.
Zacházení
Při diagnostice NLF (podle teplotních grafů v konečníku je trvání 2. fáze kratší než 11 dní, pozoruje se postupné zvyšování teploty, nedostatečná sekreční transformace endometria podle dat biopsie endometria, nízké hladiny progesteronu v krevním séru) je nutné identifikovat příčinu těchto poruch.
Pokud je NLF doprovázena hyperprolaktinémií, provádí se magnetická rezonance mozku. Alternativní metodou je rentgen lebky (oblast sella turcica).
První fází hyperprolaktinémie je vyloučení adenomu hypofýzy, což vyžaduje chirurgickou léčbu. Při absenci významných změn je hyperprolaktinémie považována za funkční a k normalizaci hladiny prolaktinu je předepsána léčba bromokriptinem. Počáteční dávka bromokriptinu je 1,25 mg/den po dobu 2 týdnů, po sledování hladiny prolaktinu, pokud se ukazatele nenormalizují, se dávka zvýší na 2,5 mg/den. Při významném zvýšení hladiny prolaktinu je počáteční dávka 2,5 mg/den. Pokud dojde k otěhotnění, je třeba bromokriptin vysadit.
Pokud je zjištěna hypotyreóza, je povaha patologie štítné žlázy stanovena společně s endokrinologem. V každém případě je indikována denní terapie levothyroxinem sodným, dávka se volí individuálně, dokud se hladina TSH normalizuje. Pokud dojde k otěhotnění, je třeba v léčbě levothyroxinem sodným pokračovat. Otázka vhodnosti zvýšení dávky v prvním trimestru těhotenství se rozhoduje společně s endokrinologem po obdržení výsledků hormonálního vyšetření (hladina TSH, volný tyroxin).
Korekce NLF se provádí jedním ze dvou způsobů. Prvním způsobem je stimulace ovulace, druhým způsobem je substituční terapie progesteronovými přípravky.
První možností léčby je stimulace ovulace klomifen citrátem. Tato léčebná metoda je založena na skutečnosti, že většina poruch luteální fáze se odehrává ve folikulární fázi cyklu. Trvale snížené hladiny progesteronu ve 2. fázi jsou důsledkem poruchy folikulogeneze v 1. fázi cyklu. Tuto poruchu lze s větším úspěchem korigovat nízkými dávkami klomifen citrátu v rané folikulární fázi než předepisováním progesteronu ve 2. fázi cyklu.
V 1. cyklu je dávka klomifen-citrátu 50 mg/den od 5. do 9. dne menstruačního cyklu. Účinnost se sleduje pomocí rektálních teplotních grafů, měření hladiny progesteronu ve 2. fázi cyklu nebo dynamického ultrazvuku. Pokud není ve 2. cyklu stimulace ovulace dostatečný účinek, měla by se dávka klomifen-citrátu zvýšit na 100 mg/den od 5. do 9. dne cyklu. Maximální možná dávka ve 3. cyklu stimulace ovulace je 150 mg/den. Takové zvýšení dávky je možné pouze tehdy, je-li lék dobře snášen (žádná intenzivní bolest v podbřišku a dolní části zad a žádné další známky ovariální hyperstimulace).
Druhá možnost léčby: substituční terapie progesteronovými přípravky, které podporují plnou sekreční transformaci endometria, což dává potřebný účinek u pacientek s habituálním potratem se zachovanou ovulací. Kromě toho bylo v posledních letech zjištěno, že podávání progesteronových přípravků má nejen hormonální, ale i imunomodulační účinek, potlačující rejekční reakce imunokompetentních buněk v endometriu. Zejména podobný účinek byl popsán u dihydrogesteronu v dávce 20 mg/den. Pro účely substituční terapie se dydrogesteron používá v dávce 20 mg/den perorálně nebo mikronizovaný progesteron vaginálně v dávce 200 mg/den. Léčba se provádí 2. den po ovulaci (den po zvýšení rektální teploty) a pokračuje 10 dní. Pokud dojde k otěhotnění, měla by léčba progesteronovými přípravky pokračovat.
Moderní výzkum nepotvrdil účinnost lidského choriového gonadotropinu v léčbě opakovaných potratů.
U hyperandrogenismu (ovariální nebo adrenální geneze) u pacientek s habituálním potratem je indikována léčba léky kvůli vlivu androgenů na úplnost ovulace a stav endometria. V případě porušení biosyntézy adrenálních androgenů je možný jejich virilizační účinek na plod ženského pohlaví, proto se steroidní terapie provádí v zájmu plodu.
Hyperandrogenismus ovariálního původu (polycystické vaječníky)
Anamnéza, fyzikální vyšetření a výsledky speciálních vyšetření
- Anamnéza: pozdní menarche, poruchy menstruačního cyklu jako oligomenorea (obvykle primární, méně často sekundární). Těhotenství jsou vzácná, obvykle spontánně přerušená v prvním trimestru, s dlouhými obdobími neplodnosti mezi těhotenstvími.
- Vyšetření: hirsutismus, akné, strie, vysoký index tělesné hmotnosti (volitelné).
- Rektální teplotní grafy: anovulační cykly se střídají s cykly s ovulací a NLF.
- Hormonální vyšetření: vysoké hladiny testosteronu, mohou být zvýšené hladiny FSH a LH, poměr LH/FSH je větší než 3. Ultrazvuk: polycystické vaječníky.
Zacházení
Nefarmakologická léčba
Hubnutí - dietní terapie, fyzická aktivita.
Léčba drogové závislosti
- Orlistat v dávce 120 mg s každým hlavním jídlem. Délka léčby se stanoví s ohledem na účinek a snášenlivost.
- Předběžné snížení hladiny testosteronu přípravky obsahujícími cyproteron-acetát (2 mg) a EE (35 mcg) po dobu 3 menstruačních cyklů.
- Vysazení antikoncepce, hormonální podpora druhé fáze cyklu (gestagenní terapie) - dydrogesteron v dávce 20 mg/den od 16. do 25. dne menstruačního cyklu. Pokud nedojde k spontánní ovulaci, pokračujte v další fázi.
- Stimulace ovulace klomifen-citrátem v počáteční dávce 50 mg/den od 5. do 9. dne menstruačního cyklu se současnou terapií gestageny (dydrogesteron v dávce 20 mg/den od 16. do 25. dne cyklu) a dexamethasonem (0,5 mg).
- Pokud nedojde k otěhotnění, dávka klomifen-citrátu se zvyšuje na 100–150 mg/den s podáváním gestagenů ve druhé fázi cyklu a dexamethasonu (0,5 mg). Bylo zjištěno, že ačkoli dexamethason snižuje pouze hladinu adrenálních androgenů, ovulace a početí se při léčbě klomifen-citrátem a dexamethasonem vyskytuje významně častěji než při použití samotného klomifen-citrátu [12].
- Provádějí se tři cykly stimulace ovulace, po kterých se doporučuje přerušení tří menstruačních cyklů s gestagenní podporou a rozhodnutí o chirurgické léčbě s využitím laparoskopického přístupu (klínová resekce vaječníků, laserová vaporizace).
Další léčba pacienta
Léčba těhotenství by měla být doprovázena gestagenní podporou až do 16. týdne těhotenství (dydrogesteron v dávce 20 mg/den nebo mikronizovaný progesteron v dávce 200 mg/den), dexamethason se předepisuje pouze v prvním trimestru těhotenství. Monitorování je povinné pro včasnou diagnostiku isthmicko-cervikální insuficience a v případě potřeby její chirurgickou korekci.
Adrenální hyperandrogenismus (pubertální a postpubertální adrenogenitální syndrom)
Adrenogenitální syndrom (AGS) je dědičné onemocnění spojené s poruchou syntézy hormonů kůry nadledvin v důsledku poškození genů zodpovědných za syntézu řady enzymových systémů. Onemocnění se dědí autozomálně recesivně s přenosem mutantních genů od obou rodičů, kteří jsou zdravými nositeli.
V 90 % případů je adrenogenitální syndrom způsoben mutacemi v genu CYP21B, což vede k narušení syntézy 21-hydroxylázy.
Anamnéza, fyzikální vyšetření a výsledky speciálních vyšetření
- Anamnéza: pozdní menarche, mírně prodloužený menstruační cyklus, možná oligomenorea, spontánní potraty v prvním trimestru, možná neplodnost.
- Vyšetření: akné, hirsutismus, androidní typ postavy (široká ramena, úzká pánev), hypertrofie klitorisu.
- Rektální teplotní grafy: anovulační cykly se střídají s cykly s ovulací a NLF.
- Hormonální test: vysoké hladiny 17-OP, DHEAS.
- Ultrazvuk: vaječníky nezměněny.
Patognomickým příznakem mimo těhotenství je zvýšení koncentrace 17-OP v krevní plazmě.
V současné době se k diagnostice latentní, neklasické formy adrenálního hyperandrogenismu používá test s ACTH. Pro tento test se používá Synacthen - syntetický polypeptid, který má vlastnosti endogenního ACTH, tj. stimuluje počáteční fáze syntézy steroidních hormonů z cholesterolu v nadledvinách.
Synacthenový test (analog ACTH): 1 ml (0,5 mg) synacthenu se aplikuje subkutánně do ramene, počáteční obsah 17-OP a kortizolu se nejprve stanoví v ranním 9hodinovém vzorku krevní plazmy. Kontrolní vzorek krve se odebere 9 hodin po injekci pro stanovení hladiny 17-OP a kortizolu. Index stanovení (D) se poté vypočítá podle vzorce:
D = 0,052 × 17-OP + 0,005 × kortizol/17-OP - 0,018 × kortizol/17-OP
Pokud je koeficient D menší nebo roven 0,069, indikuje to absenci adrenálního hyperandrogenismu. Pokud je koeficient D větší než 0,069, je třeba mít na paměti, že hyperandrogenismus je způsoben dysfunkcí nadledvin.
Léčba drogové závislosti
Základem léčby hyperandrogenismu způsobeného deficitem 21-hydroxylázy jsou glukokortikoidy, které se používají k potlačení nadměrné sekrece androgenů.
Další léčba pacienta
Vzhledem k virilizačnímu účinku mateřských androgenů na plod se při stanovení diagnózy adrenálního hyperandrogenismu léčba dexamethasonem v počáteční dávce 0,25 mg předepisuje před otěhotněním a pokračuje v individuálně zvolené dávce (od 0,5 do 1 mg) po celou dobu těhotenství. U ženy s habituálním potratem trpícím adrenálním hyperandrogenismem není vhodné léčbu vysadit, protože četnost potratů bez léčby dosahuje 14 %, s pokračující léčbou 9 %.
Vzhledem k tomu, že pacientky s adrenogenitálním syndromem mohou tento gen předat plodu, je nutné provést prenatální diagnostiku: v 17.–18. týdnu těhotenství je předepsán krevní test ke stanovení obsahu 17-OP u matky. Pokud je hladina hormonu v krvi zvýšená, stanoví se jeho koncentrace v plodové vodě. Pokud je obsah 17-OP v plodové vodě zvýšený, diagnostikuje se adrenogenitální syndrom u plodu. Bohužel není možné určit závažnost adrenogenitálního syndromu (mírná nebo těžká forma s úbytkem soli) podle hladiny 17-OP v plodové vodě. Otázku zachování těhotenství v této situaci rozhodují rodiče.
Pokud je otec dítěte nositelem genu adrenogenitálního syndromu a v rodině se vyskytly případy dětí narozených s tímto syndromem, pak pacientka, i bez adrenálního hyperandrogenismu, dostává v zájmu plodu (k prevenci virilizace plodu ženského pohlaví) dexamethason v dávce 20 mcg/kg tělesné hmotnosti, maximálně 1,5 mg/den ve 2-3 dávkách po jídle. V 17.-18. týdnu, po určení pohlaví plodu a exprese genu adrenogenitálního syndromu (na základě výsledků amniocentézy), se v léčbě pokračuje až do konce těhotenství, pokud je plodem dívka s adrenogenitálním syndromem. Pokud je plodem chlapec nebo dívka, která není nositelem genu adrenogenitálního syndromu, lze dexamethason vysadit.
Pokud žena s habituálním potratem trpí adrenálním hyperandrogenismem, pak se léčba dexamethasonem provádí po celou dobu těhotenství a vysazuje se až po porodu. 3. den po porodu se dávka dexamethasonu postupně snižuje (o 0,125 mg každé 3 dny) až do úplného vysazení v poporodním období.
Hyperandrogenismus smíšené geneze (vaječníkový a nadledvinový)
Anamnéza, fyzikální vyšetření a výsledky speciálních vyšetření
- Anamnéza: pozdní menarche, poruchy menstruačního cyklu jako oligomenorea (obvykle primární, méně často sekundární), amenorea, možná zranění, otřesy mozku. Těhotenství jsou vzácná, obvykle spontánně přerušená v prvním trimestru, dlouhá období neplodnosti mezi těhotenstvími.
- Fyzikální vyšetření: hirsutismus, akné, strie, acanthosis nigricans, vysoký index tělesné hmotnosti, hypertenze.
- Rektální teplotní grafy: anovulační cykly se střídají s cykly s ovulací a NLF.
- Hormonální vyšetření: vysoké hladiny testosteronu, mohou být zvýšené hladiny FSH a LH, poměr LH/FSH větší než 3, vysoké hladiny DHEAS, 17-OP, může být přítomna hyperprolaktinémie.
- Ultrazvuk: polycystické vaječníky.
- Elektroencefalografie: změny bioelektrické aktivity mozku.
- Hyperinzulinémie, porucha metabolismu lipidů (vysoký cholesterol, lipoproteiny s nízkou hustotou a lipoproteiny s velmi nízkou hustotou), snížená glukózová tolerance nebo zvýšené hladiny glukózy v krvi.
Zacházení
Nefarmakologická léčba
Hubnutí (nízkokalorická dieta, fyzická aktivita).
Léčba drogové závislosti
První fáze - v přítomnosti inzulínové rezistence se doporučuje předepisovat metformin v denní dávce 1000-1500 mg pro zvýšení citlivosti na inzulín.
Druhá fáze - v případě závažných poruch menstruačního cyklu a vysokých hladin testosteronu se doporučuje předepisovat léky s antiandrogenním účinkem obsahující cyproteronacetát (2 mg) a ethinylestradiol (35 mcg) po dobu 3 měsíců.
Třetí fází je stimulace ovulace, po níž následuje gestagenní podpora (schéma je popsáno výše) a užívání dexamethasonu v denní dávce 0,25–0,5 mg.
V případě hyperprolaktinémie a hypotyreózy je třeba provést vhodnou úpravu léků v cyklech stimulace ovulace. Pokud dojde k otěhotnění, je třeba bromokriptin vysadit a pokračovat v užívání levothyroxinu.
Pokud je stimulace ovulace neúčinná, je třeba rozhodnout o předepsání přímých induktorů ovulace, vhodnosti chirurgické léčby polycystických vaječníků nebo oplodnění in vitro.
Další léčba pacienta
U pacientek s metabolickým syndromem je těhotenství často komplikováno arteriální hypertenzí, nefropatií a hyperkoagulací, v souvislosti s čímž je nutné od raných fází těhotenství sledovat krevní tlak, hemostasiogramy a v případě potřeby korigovat vzniklé poruchy antihypertenzivy, antiagregačními látkami a antikoagulancii. Gestagenní léky se předepisují až do 16. týdne těhotenství - didrogesteron v dávce 20 mg/den nebo mikronizovaný progesteron v dávce 200 mg/den ve 2 dávkách.
Všechny ženy s hyperandrogenismem představují rizikovou skupinu pro rozvoj isthmicko-cervikální insuficience. Sledování stavu děložního čípku by mělo být prováděno od 16. týdne těhotenství, v případě potřeby - chirurgická korekce isthmicko-cervikální insuficience.
Imunologické příčiny habituálního potratu
V současné době je známo, že přibližně 80 % všech dříve nevysvětlených případů opakovaných potratů (po vyloučení genetických, anatomických a hormonálních příčin) je spojeno s poruchami imunity. Rozlišují se autoimunitní a aloimunitní poruchy, které vedou k habituálnímu potratu.
V autoimunitních procesech se objektem agrese stávají vlastní tkáně imunitního systému, tj. imunitní odpověď je namířena proti vlastním antigenům. V této situaci trpí druhotně plod v důsledku poškození tkání matky.
U aloimunitních poruch je imunitní odpověď ženy namířena proti embryonálním/fetálním antigenům přijatým od otce, které jsou pro tělo matky potenciálně cizí.
Mezi autoimunitní poruchy, které se nejčastěji vyskytují u pacientek s habituálním potratem, patří přítomnost antifosfolipidových, antityreoidálních a antinukleárních autoprotilátek v séru. Bylo tak zjištěno, že 31 % žen s habituálním potratem mimo těhotenství má autoprotilátky proti tyreoglobulinu a tyreoidální peroxidáze (tyreoidální mikrozomální [tyreoidální peroxidáza] autoprotilátky); v těchto případech se riziko spontánního potratu v prvním trimestru těhotenství zvyšuje na 20 %. U habituálního potratu přítomnost antinukleárních a antityreoidálních protilátek naznačuje potřebu dalšího vyšetření k identifikaci autoimunitního procesu a ověření diagnózy.
Antifosfolipidový syndrom (APS) zůstává obecně uznávaným autoimunitním onemocněním vedoucím k úmrtí embrya/plodu.
Aloimunitní poruchy
V současné době zahrnují aloimunitní procesy vedoucí k odmítnutí plodu přítomnost zvýšeného (více než 3) počtu společných antigenů hlavního systému histokompatibilního komplexu u manželů (často pozorovaného u pokrevních sňatků); nízké hladiny blokujících faktorů v séru matky; zvýšené hladiny přirozených zabíječských buněk (NK buňky CD56, CD16) v endometriu a periferní krvi matky jak mimo těhotenství, tak během něj; vysoké hladiny koncentrace řady cytokinů v endometriu a krevním séru, zejména γ-interferonu, tumor nekrotizujícího faktoru a, interleukinů-1 a 2.
V současné době se zkoumají aloimunitní faktory vedoucí k časným potratům a způsoby nápravy výše uvedených stavů. Neexistuje shoda ohledně metod terapie. Podle některých výzkumníků aktivní imunizace dárcovskými lymfocyty nepřináší významný účinek, zatímco jiní autoři popisují významný pozitivní efekt při takové imunizaci a léčbě imunoglobuliny.
V současné době je jedním z imunomodulačních činidel v časném těhotenství progesteron. Zejména studie prokázaly roli dydrogesteronu v denní dávce 20 mg u žen s habituálním potratem v prvním trimestru těhotenství se zvýšenou hladinou buněk CD56 v endometriu.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Geneticky podmíněné trombofilie
Následující formy geneticky podmíněných trombofilií jsou považovány za trombofilní stavy během těhotenství vedoucí k habituálnímu potratu.
- Nedostatek antitrombinu III.
- Mutace faktoru V (Leidenská mutace).
- Nedostatek proteinu C.
- Nedostatek proteinu S.
- Mutace genu protrombinu G20210A.
- Hyperhomocysteinémie.
Vyšetření k identifikaci vzácných příčin trombofilie je nutné v případech, kdy se vyskytly:
- rodinná anamnéza - tromboembolie před dosažením věku 40 let u příbuzných;
- spolehlivé epizody žilní a/nebo arteriální trombózy před dosažením věku 40 let;
- opakovaná trombóza u pacienta a jeho bezprostředních příbuzných;
- tromboembolické komplikace během těhotenství a po porodu při užívání hormonální antikoncepce;
- opakované potratové ztráty, mrtvě narozené děti, intrauterinní růstová retardace, odloučení placenty;
- preeklampsie s časným nástupem, HELLP syndrom.
Infekční příčiny habituálního potratu
Role infekčního faktoru jako příčiny habituálního potratu je v současnosti předmětem širokých diskusí. Je známo, že primární infekce v raných stádiích těhotenství může způsobit poškození embrya neslučitelné se životem, což vede ke sporadickým spontánním potratům. Pravděpodobnost reaktivace infekce současně s opakovanými ztrátami těhotenství je však zanedbatelná. Mikroorganismy, které by vyvolávaly habituální potrat, navíc v současnosti nebyly nalezeny. Studie z posledních let ukázaly, že většina žen s habituálním potratem a chronickou endometritidou má v endometriu prevalenci 2–3 nebo více typů obligátních anaerobních mikroorganismů a virů.
Podle V. M. Sidelnikovové a kol. byla u žen trpících habituálním potratem histologicky ověřena diagnóza chronické endometritidy mimo těhotenství v 73,1 % případů a v 86,7 % byla pozorována perzistence oportunních mikroorganismů v endometriu, což může být jistě příčinou aktivace imunopatologických procesů. Smíšená perzistující virová infekce (virus herpes simplex, Coxsackie A, Coxsackie B, enteroviry 68–71, cytomegalovirus) se u pacientek s habituálním potratem vyskytuje výrazně častěji než u žen s normální porodnickou anamnézou. K. Kohut a kol. (1997) prokázali, že procento zánětlivých změn v endometriu a deciduální tkáni u pacientek s primárním opakovaným potratem je výrazně vyšší než u žen po potratu s anamnézou alespoň jednoho donošeného porodu.
Bakteriální a virová kolonizace endometria obvykle vyplývá z neschopnosti imunitního systému a nespecifických ochranných sil těla (systém komplementu, fagocytóza) zcela eliminovat infekční agens a zároveň je jeho šíření omezeno aktivací T-lymfocytů (T-helperů, přirozených zabíječů) a makrofágů. Ve všech výše uvedených případech dochází k perzistenci mikroorganismů, která je charakterizována přitažlivostí mononukleárních fagocytů, přirozených zabíječů, T-helperů, syntetizujících různé cytokiny, k místu chronického zánětu. Zdá se, že takový stav endometria brání vzniku lokální imunosuprese v preimplantačním období, která je nezbytná pro vytvoření ochranné bariéry a zabránění odmítnutí polocizího plodu.
V tomto ohledu by měly být ženy s habituálním potratem před otěhotněním diagnostikovány s chronickou endometritidou. Pro stanovení nebo vyloučení této diagnózy se provádí biopsie endometria 7.–8. den menstruačního cyklu s histologickým vyšetřením, PCR a bakteriologickým vyšetřením materiálu z děložní dutiny. Při ověřování diagnózy se chronická endometritida léčí podle standardů pro léčbu zánětlivých onemocnění pánevních orgánů.

