Lékařský expert článku
Nové publikace
Léčba těžké sepse a septického šoku
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Účinná léčba sepse je možná pouze při úplné chirurgické sanaci ložiska infekce a adekvátní antimikrobiální terapii. Nedostatečná počáteční antimikrobiální terapie je rizikovým faktorem úmrtí u pacientů se sepsí. Udržení života pacienta, prevence a odstranění orgánových dysfunkcí je možné pouze s cílenou intenzivní péčí.
Jejím hlavním cílem je optimalizace transportu O2 za podmínek jeho zvýšené spotřeby, která je typická pro těžkou sepsi a septický šok. Tato léčba se realizuje prostřednictvím hemodynamické a respirační podpory.
Hemodynamická podpora
Infuzní terapie
Infuzní terapie je jedním z prvních opatření k udržení hemodynamiky a především srdečního výdeje. Jejími hlavními úkoly u pacientů se sepsí jsou:
- obnovení adekvátní perfuze tkání,
- korekce poruch homeostázy,
- normalizace buněčného metabolismu,
- snížení koncentrace mediátorů septické kaskády a toxických metabolitů.
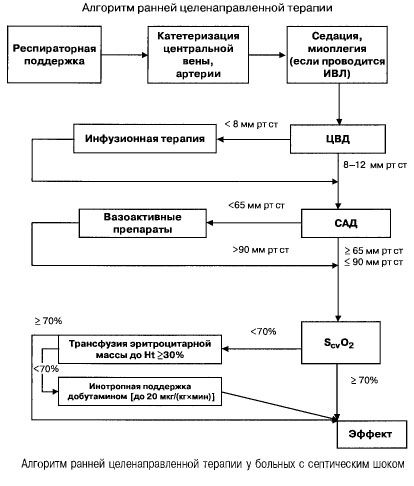
U sepse s víceorgánovým selháním a septickým šokem se snaží rychle (během prvních 6 hodin) dosáhnout následujících hodnot důležitých ukazatelů:
- hematokrit >30 %,
- diuréza 0,5 ml/(kgh),
- saturace krve v horní duté žíle nebo pravé síni >70 %,
- průměrný krevní tlak >65 mm Hg,
- CVP 8-12 mm Hg
Udržování těchto hodnot na stanovené úrovni zlepšuje přežití pacientů (kategorie důkazů B). Hemodynamické monitorování pomocí Swan-Ganzova katétru a technologie PICCO (transpulmonální termodiluce a analýza pulzní vlny) rozšiřují možnosti monitorování a hodnocení účinnosti hemodynamické terapie, ale neexistují žádné důkazy o tom, že by zlepšujily přežití.
Optimální hodnota předpětí se volí individuálně, protože je nutné zohlednit stupeň poškození endotelu a stav lymfatické drenáže v plicích, diastolickou funkci komor a změny nitrohrudního tlaku. Objem infuzní terapie se volí tak, aby PCWP nepřekročil plazmatický COP (prevence OL) a nedošlo ke zvýšení CO. Dále se zohledňují parametry charakterizující funkci výměny plynů v plicích (paO2 a paO2 / FiO2 ) a změny v rentgenovém obrazu.
Pro infuzní terapii jako součást cílené léčby sepse a septického šoku se používají krystaloidní a koloidní roztoky s prakticky identickými výsledky.
Všechna infuzní média mají své výhody i nevýhody. Vzhledem k výsledkům experimentálních a klinických studií dnes neexistuje důvod upřednostňovat žádný konkrétní typ.
- Například pro adekvátní korekci žilního návratu a úrovně předpětí je nutné podat objem krystaloidů 2–4krát větší než objem koloidů, což je spojeno se zvláštnostmi distribuce roztoku v těle. Infuze krystaloidů je navíc spojena s větším rizikem tkáňového edému a jejich hemodynamický účinek je kratší než u koloidů. Zároveň jsou krystaloidy levnější, neovlivňují koagulační potenciál a nevyvolávají anafylaktoidní reakce. Na základě výše uvedeného se kvalitativní složení infuzního programu stanoví v závislosti na charakteristikách pacienta, s přihlédnutím ke stupni hypovolemie, fázi DIC syndromu, přítomnosti periferního edému a koncentraci albuminu v krevním séru, závažnosti akutního poškození plic.
- V případech těžkého deficitu BCC jsou indikovány plazmatické náhrady (dextrany, želatinové přípravky, hydroxyethylškrob). Hydroxyethylškroby se substitučním stupněm 200/0,5, 130/0,4 a 130/0,42 mají potenciální výhodu oproti dextranům díky nižšímu riziku úniku z membrány a absenci klinicky významného vlivu na hemostázu.
- Podání albuminu v kritických stavech může zvýšit riziko úmrtí. Zvýšení COP během jeho infuze je přechodné a poté, za podmínek zvýšené propustnosti kapilárního řečiště (syndrom „kapilárního úniku“), dochází k další extravazaci albuminu. Je možné, že transfuze albuminu bude užitečná pouze tehdy, pokud je jeho koncentrace v séru nižší než 20 g/l a nejsou žádné známky „úniku“ do intersticia.
- Použití kryoplazmy je indikováno při konzumní koagulopatii a sníženém koagulačním potenciálu krve.
- Široké používání darované erytrocytární hmoty by mělo být omezeno vzhledem k vysokému riziku vzniku různých komplikací (APL, anafylaktické reakce atd.). Podle většiny odborníků je minimální koncentrace hemoglobinu u pacientů s těžkou sepsí 90-100 g/l.
Korekce hypotenze
Nízký perfuzní tlak vyžaduje okamžitou aktivaci léků, které zvyšují cévní tonus a/nebo inotropní funkci srdce. Dopamin nebo norepinefrin jsou léky první volby pro korekci hypotenze u pacientů se septickým šokem.
Dopamin (dopmin) v dávce
Norepinefrin zvyšuje průměrný arteriální tlak a zvyšuje glomerulární filtraci. Optimalizace systémové hemodynamiky pod jeho působením vede ke zlepšení renálních funkcí bez použití nízkých dávek dopaminu. Studie z posledních let ukázaly, že jeho izolované použití ve srovnání s kombinací s vysokými dávkami dopaminu vede ke statisticky významnému snížení mortality.
Adrenalin je adrenergní lék s nejvýraznějšími hemodynamickými vedlejšími účinky. Má na dávce závislý účinek na srdeční frekvenci, střední arteriální tlak, srdeční výdej, funkci levé komory a dodávku a spotřebu O2 . Současně se však vyskytují tachyarytmie, zhoršení průtoku krve orgány a hyperlaktatemie. Použití adrenalinu je proto omezeno na případy úplné refrakternosti na jiné katecholaminy.
Dobutamin je lékem volby pro zvýšení dodávky a spotřeby CO2 a O2 při normálním nebo zvýšeném předpětí. Vzhledem k jeho převažujícímu účinku na beta1-adrenergní receptory je při zvyšování těchto parametrů účinnější než dopamin.
Experimentální studie ukázaly, že katecholaminy kromě podpory krevního oběhu mohou regulovat průběh systémového zánětu ovlivňováním syntézy klíčových mediátorů se vzdáleným účinkem. Pod vlivem adrenalinu, dopaminu, noradrenalinu a dobutaminu aktivované makrofágy snižují syntézu a sekreci TNF-a.
Výběr adrenergních látek se provádí podle následujícího algoritmu:
- srdeční index 3,5-4 l/(min x m² ), SvO² > 70 % - dopamin nebo norepinefrin,
- srdeční index m2 ), SvO2
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Podpora dýchání
Plíce patří mezi první cílové orgány zapojené do patologického procesu sepse. Akutní respirační selhání je jednou z hlavních složek multiorgánové dysfunkce. Jeho klinické a laboratorní projevy u sepse odpovídají ALI a s progresí patologického procesu - ARDS. Indikace pro mechanickou ventilaci u těžké sepse se určují v závislosti na závažnosti parenchymatózního respiračního selhání (ARF nebo ARDS). Jejím kritériem je respirační index:
- >200 - hodnoty se určují individuálně.
Pokud je pacient při spontánním dýchání s kyslíkovou podporou při vědomí, nedochází k vysokému vynaložení dechové práce a výrazné tachykardii (TF > 90 %, pak je možné upustit od převedení na umělou plicní ventilaci. Je však nutné pečlivě sledovat stav pacienta. Optimální hodnota SO2 je asi 90 %. Lze ji udržovat různými metodami podávání plynu (obličejové masky, nosní katétry) v netoxických koncentracích (FiO2 0,6). Neinvazivní umělá plicní ventilace je u sepse kontraindikována (kategorie důkazů B).
Je třeba se vyhnout režimům vysokoobjemové mechanické ventilace (MVV) (VO2 = 12 ml/kg), protože v takových případech se zvyšuje sekrece cytokinů plicními buňkami, což vede ke zhoršení MOF. Je nutné dodržovat koncept bezpečné mechanické ventilace, která je možná, pokud jsou splněny následující podmínky (kategorie důkazů A):
- Rozpuštěný kyslík
- neinvertovaný poměr nádechu a výdechu,
- maximální tlak v dýchacích cestách
- FiO2 .
Výběr parametrů dýchacího cyklu se provádí až do dosažení adekvátní mechanické ventilace, jejími kritérii jsou paO2 > 60 mm Hg, SpO2 > 88–93 %, pvO2 35–45 mm Hg, SvO2 > 55 %.
Jednou z účinných metod pro optimalizaci výměny plynů je provádění umělé plicní ventilace v poloze na břiše (Prone Positioning) (kategorie důkazů B). Tato poloha je účinná u pacientů v nejtěžším stavu, ačkoli její vliv na snížení mortality v dlouhodobém horizontu je statisticky nevýznamný.
Nutriční podpora
Provádění umělé nutriční podpory je důležitým prvkem léčby, jedním z povinných opatření, protože rozvoj syndromu víceorgánového selhání u sepse je obvykle doprovázen projevy hypermetabolismu. V takové situaci jsou energetické potřeby uspokojovány destrukcí vlastních buněčných struktur (autokanibalismus), což zhoršuje orgánovou dysfunkci a zvyšuje endotoxikózu.
Nutriční podpora je považována za metodu prevence těžkého vyčerpání (deficit bílkovin a energie) na pozadí výrazného zvýšení kata- a metabolismu. Zařazení enterální výživy do komplexu intenzivní terapie zabraňuje pohybu střevní mikroflóry, dysbakterióze, zvyšuje funkční aktivitu enterocytů a ochranné vlastnosti střevní sliznice. Tyto faktory snižují stupeň endotoxikózy a riziko sekundárních infekčních komplikací.
Výpočet nutriční podpory:
- energetická hodnota - 25-35 kcal/(kg tělesné hmotnosti x den),
- množství bílkovin - 1,3-2,0 g/(kg tělesné hmotnosti x den),
- množství sacharidů (glukózy) - méně než 6 g/kg/den,
- množství tuku - 0,5-1 g/kg/den,
- glutaminové dipeptidy 0,3–0,4 g/kg/den,
- vitamíny - standardní denní dávka + vitamín K (10 mg/den) + vitamíny B1 a B6 ( 100 mg/den) + vitamíny A, C, E,
- mikroelementy - standardní denní dávka + Zn (15-20 mg/den + 10 mg/den při řídké stolici),
- elektrolyty - Na+, K+, Ca2+ dle bilančních výpočtů a koncentrace v plazmě.
Časné zahájení nutriční podpory (24–36 hodin) je účinnější než 3.–4. den intenzivní terapie (kategorie důkazů B), zejména při enterální výživě sondou.
U těžké sepse neexistují žádné výhody enterální ani parenterální výživy; doba trvání orgánové dysfunkce a doba trvání respirační a inotropní podpory jsou stejné a míra úmrtnosti je stejná. Vzhledem k výše uvedenému je časná enterální výživa levnější alternativou parenterální výživy. Použití směsí obohacených o vlákninu (prebiotika) pro sondovou výživu významně snižuje výskyt průjmu u pacientů s těžkou sepsí.
Pro efektivní syntézu bílkovin v těle je důležité udržovat metabolický poměr „celkový dusík, g - neproteinové kalorie, kcal“ = 1-(110-130). Maximální dávka sacharidů je 6 g / (kg tělesné hmotnosti za den), protože podání velkých dávek ohrožuje hyperglykémii a aktivaci katabolismu v kosterních svalech. Tukové emulze se doporučuje podávat nepřetržitě.
Kontraindikace pro nutriční podporu:
- dekompenzovaná metabolická acidóza,
- individuální intolerance na nutriční podpůrná média,
- těžká neléčená hypovolemie,
- refrakterní šok - dávka dopaminu >15 mcg/(kg x min) a systolický krevní tlak
- těžká neléčitelná arteriální hypoxémie.
Glykemická kontrola
Důležitým aspektem komplexní léčby těžké sepse je neustálé sledování koncentrace glukózy v krevní plazmě a inzulinová terapie. Vysoká glykémie a potřeba její korekce jsou faktory nepříznivého výsledku sepse. Vzhledem k výše uvedeným okolnostem je u pacientů udržována normoglykémie (4,5-6,1 mmol/l), u kterých se při zvýšení koncentrace glukózy nad přijatelné hodnoty provádí infuze inzulinu (0,5-1 U/h). V závislosti na klinické situaci se koncentrace glukózy monitoruje každé 1-4 hodiny. Při implementaci tohoto algoritmu byl zaznamenán statisticky významný nárůst přežití pacientů.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoidy
Výsledky moderních studií týkajících se účinnosti užívání glukokortikoidů u pacientů se septickým šokem jsou shrnuty v následujících tvrzeních:
- Není vhodné používat hormony ve vysokých dávkách [methylprednisolon 30-120 mg/(kg x den) jednou nebo po dobu 9 dnů, dexamethason 2 mg/(kg x den) po dobu 2 dnů, betamethason 1 mg/(kg x den) po dobu 3 dnů] - zvýšené riziko nozokomiálních infekcí, žádný vliv na přežití,
- Užívání hydrokortizonu v dávce 240-300 mg denně po dobu 5-7 dnů urychluje stabilizaci hemodynamických parametrů, umožňuje ukončení cévní podpory a zlepšuje přežití u pacientů se souběžnou relativní adrenální insuficiencí (kategorie důkazů B).
Je nutné opustit chaotické empirické předepisování prednisolonu a dexamethasonu - neexistují žádné důvody pro extrapolaci nových informací na ně. Při absenci laboratorních důkazů relativní adrenální insuficience se podává hydrokortizon v dávce 300 mg denně (ve 3-6 injekcích).
- v refrakterním šoku,
- pokud jsou k udržení účinné hemodynamiky nutné vysoké dávky vazopresorů.
Je možné, že za podmínek systémového zánětu v septickém šoku je účinnost hydrokortizonu spojena s aktivací inhibitoru nukleárního faktoru kB (NF-kB-a) a korekcí relativní adrenální insuficience. Inhibice aktivity transkripčního nukleárního faktoru (NF-kB) následně vede ke snížení tvorby indukovatelné NO syntetázy (NO je nejsilnější endogenní vazodilatátor), prozánětlivých cytokinů, COX a adhezních molekul.
Aktivovaný protein C
Jedním z charakteristických projevů sepse je narušení systémové koagulace (aktivace koagulační kaskády a inhibice fibrinolýzy), což v konečném důsledku vede k hypoperfúzi a orgánové dysfunkci. Účinek aktivovaného proteinu C na zánětlivý systém se realizuje několika způsoby:
- snížení vazby selektinu na leukocyty, což chrání endotel před poškozením, což hraje klíčovou roli ve vývoji systémového zánětu,
- snížené uvolňování cytokinů z monocytů,
- blokování uvolňování TNF-a z leukocytů,
- inhibice produkce trombinu (zesiluje zánětlivou reakci).
Antikoagulační, profibrinolytický a protizánětlivý účinek
- aktivovaný protein C je způsoben
- degradace faktorů Va a VIIIa - potlačení tvorby trombů,
- potlačení inhibitoru aktivátoru plazminogenu - aktivace fibrinolýzy,
- přímý protizánětlivý účinek na endotelové buňky a neutrofily,
- ochrana endotelu před apoptózou
Podávání aktivovaného proteinu C [drotrekogin alfa (aktivovaný)] v dávce 24 mcg/(kg h) po dobu 96 h snižuje riziko úmrtí o 19,4 %. Indikace k podání: sepse s akutní MOF a vysokým rizikem úmrtí (APACHE II > 25 bodů, dysfunkce 2 nebo více orgánů, kategorie důkazů B).
Aktivovaný protein C nesnižuje mortalitu u dětí, pacientů s dysfunkcí jednoho orgánu, APACHE II
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Imunoglobuliny
Vhodnost intravenózního podávání imunoglobulinů (IgG a IgG+IgM) je spojena s jejich schopností omezit nadměrné působení prozánětlivých cytokinů, zvýšit clearance endotoxinů a stafylokokového superantigenu, eliminovat anergii a zesílit účinek ß-laktamových antibiotik. Jejich použití v léčbě těžké sepse a septického šoku je jedinou metodou imunokorekce, která zvyšuje přežití. Nejlepší účinek byl zaznamenán při použití kombinace IgG a IgM [RR=0,48 (0,35-0,75), kategorie důkazů A]. Standardní dávkovací režim je 3-5 ml/(kg x den) po dobu 3 dnů po sobě. Při použití imunoglobulinů byly nejoptimálnější výsledky dosaženy v rané fázi šoku („teplý šok“) a u pacientů s těžkou sepsí (skóre APACHE II 20-25 bodů).
Prevence hluboké žilní trombózy
Prevence hluboké žilní trombózy dolních končetin významně ovlivňuje výsledky léčby pacientů se sepsí (kategorie důkazů A). K tomuto účelu se používají jak nefrakcionované, tak nízkomolekulární hepariny. Hlavními výhodami nízkomolekulárních heparinů jsou nižší výskyt hemoragických komplikací, slabší vliv na funkci krevních destiček a dlouhodobý účinek (lze podávat jednou denně).
Prevence tvorby stresových vředů gastrointestinálního traktu
Tento směr hraje významnou roli v příznivém výsledku léčby pacientů s těžkou sepsí a septickým šokem, jelikož úmrtnost na krvácení ze stresových vředů gastrointestinálního traktu je 64-87 %. Bez preventivních opatření se stresové vředy vyskytují u 52,8 % kriticky nemocných pacientů. Užívání inhibitorů protonové pumpy a blokátorů histaminových H2 receptorů však snižuje riziko více než 2krát (první skupina léků je účinnější než druhá). Hlavním směrem prevence a léčby je udržování pH v rozmezí 3,5-6,0. Je třeba zdůraznit, že kromě výše uvedených léků hraje důležitou roli v prevenci vzniku stresových vředů enterální výživa.
Mimotělní čištění krve
Různé biologicky aktivní látky a metabolické produkty podílející se na rozvoji generalizovaného zánětu jsou cílem detoxikačních metod, což je obzvláště důležité při absenci přirozené hepatorenální clearance v podmínkách polyorgánového selhání. Metody renální substituční terapie jsou považovány za slibné, protože mohou ovlivnit nejen uremické poruchy u pacientů s renálním selháním, ale také pozitivně ovlivnit další změny homeostázy a orgánové dysfunkce, ke kterým dochází při sepsi, šoku a polyorgánovém selhání.
Dosud neexistují žádné údaje potvrzující potřebu použití extrakorporálních metod čištění krve jako jednoho z hlavních směrů patogenetické terapie sepse a septického šoku. Jejich použití je odůvodněné v případě víceorgánového selhání s dominancí ledvin.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hemodialýza
Podstatou metody je difuze látek s nízkou molekulovou hmotností (až 5x103 Da ) přes semipermeabilní membránu a odstraňování přebytečné tekutiny z těla podél tlakového gradientu. Hemodialýza se široce používá k léčbě pacientů s chronickým i akutním selháním ledvin. Rychlost difuze látek exponenciálně závisí na jejich molekulové hmotnosti. Například odstraňování oligopeptidů je pomalejší než jejich syntéza.
Hemofiltrace
Hemofiltrace je účinná metoda pro odstraňování látek s molekulovou hmotností 5x10³ - 5x10⁴ Da a jediný způsob, jak z těla odstranit velkou skupinu biologicky aktivních látek a metabolitů. Metoda je založena na konvekční metodě přenosu hmoty. Kromě adekvátní korekce azotémie hemofiltrace účinně odstraňuje anafylatoxiny C3a, C5a, prozánětlivé cytokiny (TNF-a, IL-1b, 6 a 8), ß2-mikroglobulin, myoglobin, parathormon, lysozym (molekulová hmotnost - 6000 Da), α-amylázu (molekulová hmotnost - 36 000-51 000 Da), kreatinfosfokinázu, alkalickou fosfatázu, transaminázy a další látky. Hemofiltrace odstraňuje aminokyseliny a plazmatické proteiny (včetně imunoglobulinů a cirkulujících imunitních komplexů).
Hemodiafiltrace
Hemodiafiltrace je nejúčinnější metodou čištění krve, která kombinuje difuzi a konvekci (tj. GD a GF). Dalším přínosem k detoxikačnímu procesu je sorpce patologických látek na filtrační membráně.
Plazmaferéza
Plazmaferéza (plazmavýměna, plazmafiltrace) je také považována za možnou metodu korekce generalizovaného zánětu u pacientů se sepsí a septickým šokem. Za optimální metodu se považuje použití plazmavýměny v kontinuálním režimu s odebráním 3–5 objemů plazmy a její současnou náhradou čerstvě zmrazenými, albuminovými, koloidními a krystaloidními roztoky. S prosévacím koeficientem 1 zajišťuje plazmafiltrace dobré odstranění C-reaktivního proteinu, haptoglobinu, fragmentu komplementu C3, 1-antitrypsinu, IL-6, tromboxanu B2, granulocyty stimulujícího faktoru, TNF. Použití sorbentů k čištění plazmy pacienta snižuje riziko infekce a snižuje náklady na zákrok, protože není nutné používat cizí proteiny.
Použití prodloužené infuze seleničitanu sodného (selenázy) v dávce 1000 mcg/den u těžké sepse vede ke snížení mortality.
Selen je esenciální mikroelement, jehož význam je spojen s jeho klíčovou rolí v antioxidačních systémech buněk. Hladina selenu v krvi se udržuje v rozmezí 1,9-3,17 μM/l. Potřeba selenu je 50-200 μg denně a závisí na dostupnosti dalších antioxidantů a mikroelementů.
Selen je silný antioxidant, součást glutathionperoxidázy, fosfolinglutathionperoxidázy, dalších oxidoreduktáz a některých transferáz. Glutathionperoxidáza je nejdůležitějším článkem endogenního antioxidačního systému.
Účinnost selenu v kritických podmínkách byla v posledních letech studována. Tyto studie ukázaly, že hlavní mechanismy účinku selenu jsou:
- potlačení hyperaktivace NF-kB;
- snížená aktivace komplementu;
- jeho působení jako imunomodulátoru, antioxidantu a protizánětlivého činidla
- udržování využití peroxidu;
- potlačení endoteliální adheze (snížená exprese ICAM-1, VCAM-2,
- E - selektin, P - selektin);
- ochrana endotelu před oxyradikály (pomocí selenoproteinu P, který zabraňuje tvorbě peroxynitritu z O2 a NO).
Abychom shrnuli výše uvedené, můžeme definovat specifické úkoly intenzivní péče o těžkou sepsi:
- Hemodynamická podpora: CVP 8-12 mm Hg, průměrný krevní tlak >65 mm Hg, diuréza 0,5 ml/(kg h), hematokrit >30 %, saturace smíšené žilní krve >70 %.
- Respirační podpora: vrcholový tlak v dýchacích cestách
- Glukokortikoidy - „nízké dávky“ (hydrokortizon 240-300 mg denně).
- Aktivovaný protein C 24 mcg/(kg h) po dobu 4 dnů při těžké sepsi (APACHE II > 25).
- Imunokorekční substituční terapie pentaglobinem.
- Prevence hluboké žilní trombózy dolních končetin.
- Prevence tvorby stresových vředů gastrointestinálního traktu: použití inhibitorů protonové pumpy a blokátorů H2-histaminových receptorů.
- Substituční terapie pro akutní selhání ledvin.
- Nutriční podpora: energetická hodnota potravy 25-30 kcal/kg tělesné hmotnosti x den), bílkoviny 1,3-2,0 g/(kg tělesné hmotnosti x den), glutaminové dipeptidy 0,3-0,4 g/(kg x den), glukóza - 30-70 % neproteinových kalorií za předpokladu udržení glykémie

