Lékařský expert článku
Nové publikace
Virus lidské imunodeficience (HIV)
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Syndrom získané imunodeficience byl identifikován jako specifické onemocnění v roce 1981 ve Spojených státech, kdy se u řady mladých lidí rozvinuly závažné nemoci způsobené mikroorganismy, které byly pro zdravé lidi nepatogenní nebo slabě patogenní. Studie imunitního stavu pacientů odhalila prudký pokles počtu lymfocytů obecně a zejména T-helperů. Tento stav byl nazván AIDS (syndrom získané imunodeficience). Způsob infekce (pohlavní styk, prostřednictvím krve a jejích přípravků) naznačoval infekční povahu onemocnění.
Původce AIDS byl objeven nezávisle v roce 1983 Francouzem L. Montagnierem, který jej nazval LAV lymfadenopathy Associated Virus, protože jej nalezl u pacienta s lymfadenopatií; a Američanem R. Gallem, který virus nazval HTLV-III (Human T-lymfotropní virus III): předtím objevil lymfotropní viry I a II.
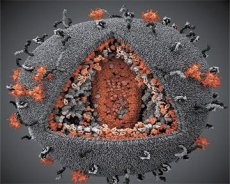
Porovnání vlastností virů LAV a HTLV-III ukázalo jejich identitu, a proto byl virus v roce 1986, aby se předešlo záměně, pojmenován HIV (Human Immunodeficiency Virus, neboli HIV). HIV má kulovitý tvar o průměru 110 nm. Virový obal má tvar mnohostěnu, složeného z 12 pětiúhelníků a 20 šestiúhelníků. Ve středu a v rozích každého šestiúhelníku se nachází molekula glykosylovaného proteinu gpl20 (číslo 120 udává molekulovou hmotnost proteinu v kilodaltonech). Na povrchu virionu se nachází celkem 72 molekul gpl20 ve formě zvláštních hrotů, z nichž každý je asociován s intramembránovým proteinem gp41. Tyto proteiny spolu s dvojitou lipidovou vrstvou tvoří superkapsidu (membránu) virionu.
Proteiny gpl20 a gp41 vznikají rozštěpením prekurzorového proteinu Env buněčnou proteázou. Protein gp41 tvoří „stonek“ hrotu vazbou své cytoplazmatické domény na matrixový protein p17MA umístěný přímo pod obalem. Molekuly p17 interagují během zrání virionu a vytvářejí ikosahedron pod obalem.
V centrální části virionu tvoří protein p24 kuželovitou kapsidu. Zúžená část kapsidy je za účasti proteinu rb spojena s virionovou membránou. Uvnitř kapsidy se nacházejí dvě identické molekuly virové genomové RNA. Jsou svými 5' konci spojeny s nukleokapsidovým proteinem p7NC. Tento protein je zajímavý, protože má dva aminokyselinové zbytky (motivy) bohaté na cystein a histidin a obsahující atom Zn – nazývají se „zinkové prsty“, protože zachycují molekuly genomové RNA pro začlenění do vznikajících virionů. Kapsida také obsahuje tři enzymy. Revertáza (RT), neboli pol komplex, zahrnuje reverzní transkriptázu, RNázu H a DNA-dependentní DNA polymerázu. Revertáza je přítomna jako heterodimer p66/p51. Proteáza (PR) – p10, iniciuje a realizuje proces zrání virionu. Integráza (IN) - p31 neboli endonukleáza zajišťuje začlenění provirové DNA do genomu hostitelské buňky. Kapsida také obsahuje molekulu primeru RNA (tRNA1"3).
RNA genom v buňce je pomocí reverzní transkriptázy přeměněn na DNA genom (DNA provirus), který se skládá z 9283 párů nukleotidů. Zleva a zprava je ohraničen tzv. dlouhými terminálními repeticemi neboli LTR: S'-LTR vlevo a 3'-LTR vpravo. LTR obsahují každá 638 párů nukleotidů.
Genom HIV se skládá z 9 genů, z nichž některé se na koncích překrývají (mají několik čtecích rámců) a mají exonintronovou strukturu. Řídí syntézu 9 strukturních a 6 regulačních proteinů.
Význam LTR pro virový genom spočívá v tom, že obsahují následující regulační prvky, které řídí jeho fungování:
- transkripční signál (promotorová oblast);
- signál adice poly-A;
- signál omezení;
- integrační signál;
- signál pozitivní regulace (TAR pro protein TAT);
- negativní regulační element (NRE pro protein NEF);
- místo pro připojení primeru RNA (tRNA™3) pro syntézu mínusového řetězce DNA na 3' konci; signál na 5' konci LTR, který slouží jako primer pro syntézu plusového řetězce DNA.
Kromě toho LTR obsahuje prvky zapojené do regulace sestřihu mRNA, balení molekul vRNA do kapsidy (prvek Psi). Konečně, během transkripce genomu se v dlouhých mRNA tvoří dva signály pro protein REV, které přepínají syntézu proteinů: CAR - pro regulační proteiny a CRS - pro strukturní proteiny. Pokud se protein REV naváže na CAR, syntetizují se strukturní proteiny; pokud chybí, syntetizují se pouze regulační proteiny.
Následující regulační geny a jejich proteiny hrají obzvláště důležitou roli v regulaci fungování virového genomu:
- Protein TAT, který provádí pozitivní kontrolu replikace viru a působí prostřednictvím regulační oblasti TAR;
- Proteiny NEV a VPU, které vykonávají negativní kontrolu replikace prostřednictvím oblasti NRE;
- REV protein, který provádí pozitivně-negativní kontrolu. REV protein řídí práci genů gag, pol, env a provádí negativní regulaci sestřihu.
Replikace HIV je tedy pod trojí kontrolou – pozitivní, negativní a pozitivně-negativní.
Protein VIF určuje infekčnost nově syntetizovaného viru. Je asociován s kapsidovým proteinem p24 a je ve virionu přítomen v množství 60 molekul. Protein NEF je ve virionu zastoupen malým počtem molekul (5-10), pravděpodobně asociovaných s obalem.
Protein VPR inhibuje buněčný cyklus ve fázi G2, podílí se na transportu preintegračních komplexů do buněčného jádra, aktivuje některé virové a buněčné geny a zvyšuje účinnost replikace viru v monocytech a makrofágech. Umístění proteinů VPR, TAT, REV a VPU ve virionu nebylo dosud stanoveno.
Kromě vlastních proteinů může virionová membrána obsahovat i některé proteiny hostitelské buňky. Proteiny VPU a VPR se podílejí na regulaci virové reprodukce.
Antigenní varianty viru lidské imunodeficience (HIV)
Virus lidské imunodeficience (HIV) je velmi variabilní. I z těla jednoho pacienta lze izolovat virové kmeny, které se významně liší antigenními vlastnostmi. Tato variabilita je usnadněna intenzivní destrukcí CD4+ buněk a silnou protilátkovou odpovědí na HIV infekci. Z pacientů ze západní Afriky byla izolována nová forma HIV, HIV-2, biologicky blízká HIV-1, ale imunologicky odlišná. Homologie primární struktury genomů těchto virů je 42 %. DNA provirus HIV-2 obsahuje 9671 bp a jeho LTR - 854 bp. HIV-2 byl následně izolován v dalších regionech světa. Mezi HIV-1 a HIV-2 neexistuje zkřížená imunita. Jsou známy dvě velké formy HIV-1: O (Outlier) a M (Major), přičemž druhý jmenovaný je rozdělen do 10 podtypů (AJ). V Rusku cirkuluje osm podtypů (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mechanismus interakce HIV s buňkou
Po proniknutí do těla virus nejprve napadá buňky obsahující specifický receptor CD4. Tento receptor je ve velkém množství přítomen v T-helperech, v menším množství v makrofágech a monocytech, přičemž T-helpery jsou na virus obzvláště citlivé.
Virus lidské imunodeficience (HIV) rozpoznává receptory CD4 pomocí svého proteinu gpl20. Proces interakce HIV s buňkou probíhá podle následujícího schématu: adsorpce zprostředkovaná receptorem -> potažená jamka -> potažený váček -> lysozom. V něm se virionová membrána spojí s lysozomovou membránou a nukleokapsida, uvolněná ze superkapsidy, vstupuje do cytoplazmy; cestou do jádra je zničena a uvolní se genomová RNA a související složky jádra. Poté reverzní transkriptáza syntetizuje mínusový řetězec DNA na virionové RNA, poté RNáza H ničí virionovou RNA a virová DNA polymeráza syntetizuje kladný řetězec DNA. Na koncích DNA proviru se tvoří 5'-LTR a 3'-LTR. DNA provirus může v jádře nějakou dobu zůstat v neaktivní formě, ale dříve či později se pomocí své integrázy integruje do chromozomu cílové buňky. V něm provirus zůstává neaktivní, dokud daný T-lymfocyt není aktivován mikrobiálními antigeny nebo jinými imunokompetentními buňkami. Aktivace buněčné transkripce DNA je regulována speciálním jaderným faktorem (NF-kB). Jedná se o protein vázající DNA a je produkován ve velkém množství během aktivace a proliferace T-lymfocytů a monocytů. Tento protein se váže na určité sekvence buněčné DNA a podobné LTR sekvence DNA proviru a indukuje transkripci jak buněčné DNA, tak DNA proviru. Indukcí transkripce DNA proviru provádí přechod viru z neaktivního stavu do aktivního, a tedy z perzistující infekce do produktivní. Provirus může zůstat v neaktivním stavu po velmi dlouhou dobu. Aktivace viru je kritickým momentem v jeho interakci s buňkou.
Od okamžiku, kdy virus pronikne do buňky, začíná období HIV infekce - stav vironosiče, který může trvat 10 let i déle; a od okamžiku aktivace viru začíná onemocnění - AIDS. S pomocí svých regulačních genů a jejich produktů se virus začíná aktivně množit. Protein TAT může 1000krát zvýšit rychlost reprodukce viru. Virová transkripce je složitá. Zahrnuje tvorbu mRNA v plné délce i subgenomové mRNA, sestřih mRNA a následně dochází k syntéze strukturních a regulačních proteinů.
Syntéza strukturních proteinů probíhá následovně. Nejprve se syntetizuje prekurzorový polyprotein Pr55Gag (protein s molekulovou hmotností 55 kDa). Obsahuje 4 hlavní domény: matrixovou (MA), kapsidovou (CA), nukleokapsidovou (NC) a doménu rb, ze které se v důsledku štěpení Pr55Gag virovou proteázou (samostatně se štěpí z jiného prekurzorového proteinu, Gag-Pol) tvoří strukturní proteiny p17, p24, p7 a rb. Tvorba polyproteinu Pr55Gag je hlavní podmínkou pro tvorbu virových částic. Právě tento protein určuje program morfogeneze virionu. Postupně zahrnuje fáze transportu polyproteinu Gag na plazmatickou membránu, interakci s ní a interakce protein-protein během tvorby virové částice a jejího pučení. Pr55Gag se syntetizuje na volných polyribozomech; molekuly proteinů jsou transportovány na membránu, kde jsou ukotveny svými hydrofobními oblastmi. Doména CA hraje hlavní roli při vytváření nativní konformace proteinu Gag. Doména NC zajišťuje (s pomocí svých „zinkových prstů“) zahrnutí 2 molekul genomové RNA do složení vznikající virové částice. Molekula polyproteinu zpočátku dimerizuje v důsledku interakce matrixových domén. Poté se dimery v důsledku interakce domén CA a NC spojí do hexamerních (o 6 jednotkách) komplexů. Nakonec hexamery, spojující se na svých bočních površích, tvoří nezralé sférické viriony, uvnitř kterých je obsažena genomová virová RNA zachycená doménou NC.
Další prekurzorový protein, Prl60Gag-Pol (protein s molekulovou hmotností 160 kDa), je syntetizován v důsledku posunu čtecího rámce ribozomem během translace 3'-konce genu gag v oblasti umístěné bezprostředně před oblastí kódující protein rb. Tento polyprotein Gag-Pol obsahuje neúplnou sekvenci proteinu Gag (1-423 aminokyselin) a sekvence Pol, které zahrnují domény PR, RT a IN. Molekuly polyproteinu Gag-Pol jsou také syntetizovány na volných polyribozomech a jsou transportovány do plazmatické membrány. Polyprotein Prl60Gagpol obsahuje všechna intermolekulární interakční místa a vazebná místa pro membránu, která jsou vlastní polyproteinu Gag. Molekuly polyproteinu Gag-Pol se proto spojí s membránou a spolu s molekulami Gag jsou zahrnuty do tvořících se virionů, což vede ke vzniku aktivní proteázy a zahájení procesu zrání virionu. Proteáza HIV-1 je vysoce aktivní pouze ve formě dimeru, proto je pro její samovyštěpení z Prl60Gag-Pol nutná dimerizace těchto molekul. Zrání virionu spočívá v tom, že uvolněná aktivní proteáza štěpí prl60Gag-Pol a Gag55 v místech, která rozpoznává; vznikají proteiny p17, p24, p7, p6, revertáza, integráza a dochází k jejich asociaci do virové struktury.
Protein Env je syntetizován na ribozomech asociovaných s membránami endoplazmatického retikula, poté je glykosylován, buněčnou proteázou štěpen na gp120 a gp41 a transportován na buněčný povrch. V tomto případě gp41 proniká membránou a váže se na matrixové domény molekuly proteinu Gag asociované s vnitřním povrchem membrány. Toto spojení je zachováno i ve zralém virionu.
Sestavení virových částic tedy spočívá v agregaci prekurzorových proteinů a asociovaných molekul RNA na plazmatické membráně hostitelské buňky, tvorbě nezralých virionů a jejich uvolnění pučením z buněčného povrchu. Během pučení se virion obklopí buněčnou membránou, do které jsou molekuly gp41 a gp120 vloženy. Během pučení nebo případně po uvolnění virionů dochází k jejich zrání, které se provádí za pomoci virové proteázy a spočívá v proteolytickém štěpení prekurzorových proteinů Pr55Gag a Prl60Gag-Pol na proteiny zralého viru a jejich asociaci do určitých strukturních komplexů. Vedoucí roli v procesech virové morfogeneze hraje prekurzorový polyprotein Pr55Gag, který organizuje a sestavuje nezralý virion; proces jeho zrání je dokončen specifickou virovou proteázou.
Příčiny imunodeficience
Jednou z hlavních příčin imunodeficience u HIV infekce je hromadná smrt T-helperů. Dochází k ní v důsledku následujících událostí. Zaprvé, T-helpery infikované virem umírají v důsledku apoptózy. Předpokládá se, že u pacientů s AIDS je replikace viru, apoptóza a snížení počtu T-helperů vzájemně propojeny. Zadruhé, T-killery rozpoznávají a ničí T-buňky infikované virem nebo nesoucí adsorbované molekuly gpl20, stejně jako virem infikované i nevirem infikované T-helpery, které tvoří symplasty (syncytium) sestávající z několika desítek buněk (některé z nich umírají v důsledku reprodukce virů v nich). V důsledku destrukce velkého počtu T-helperů dochází ke snížení exprese membránových receptorů v B-lymfocytech pro interleukin-2, je narušena syntéza různých interleukinů (růstové faktory a diferenciační faktory B-lymfocytů - IL-4, IL-5, IL-6 atd.), což má za následek narušení funkce systému T-killerů. Aktivita komplementu a makrofágového systému je potlačena. Makrofágy a monocyty infikované virem dlouhodobě neumírají, ale nejsou schopny virus z těla odstranit. Konečně, vzhledem ke strukturní a antigenní podobnosti gpl20 s receptory některých epiteliálních buněk těla (včetně receptorů trofoblastů zprostředkovávajících přenos HIV po transplantaci), jsou syntetizovány antireceptorové protilátky se širokým spektrem účinku. Takové protilátky jsou schopny blokovat různé buněčné receptory a komplikovat průběh onemocnění autoimunitními poruchami. Důsledkem HIV infekce je poškození všech hlavních článků imunitního systému. Tito pacienti se stávají bezbrannými vůči široké škále mikroorganismů. To vede k rozvoji oportunních infekcí a nádorů. U pacientů s HIV infekcí se zvyšuje riziko vzniku nejméně tří typů rakoviny: Kaposiho sarkom; karcinom (včetně rakoviny kůže); B-buněčný lymfom, který vzniká v důsledku maligní transformace B-lymfocytů. HIV však není jen lymfocytotropní, ale také neurotropní. Proniká do buněk centrálního nervového systému (astrocytů) jak receptorem zprostředkovanou endocytózou, tak fagocytózou virem infikovaných lymfoblastů astrocyty. Při interakci viru s astrocyty se také tvoří symplasty, které usnadňují šíření patogenu mezibuněčnými kanály. Virus může v makrofágech a monocytech dlouhodobě přetrvávat, takže slouží jako jeho rezervoár a distributor v těle a jsou schopny proniknout do všech tkání. Infikované makrofágy hrají hlavní roli při zavádění HIV do centrálního nervového systému a jeho poškození. U 10 % pacientů jsou primární klinické syndromy spojeny s poškozením centrálního nervového systému a projevují se jako demence. Lidé infikovaní HIV jsou tedy charakterizováni 3 skupinami onemocnění - oportunními infekcemi,nádorová onemocnění a poškození centrálního nervového systému.
Epidemiologie HIV infekce
Zdrojem HIV infekce je pouze člověk – nemocný nebo vironosič. Virus lidské imunodeficience (HIV) je obsažen v krvi, spermiích, cervikální tekutině; u kojících matek v mateřském mléce. K infekci dochází sexuálně, prostřednictvím krve a jejích přípravků, a také z matky na dítě před porodem, během něj a po porodu. Případy infekce virem prostřednictvím jídla, nápojů a bodnutí hmyzem nejsou známy.
Drogová závislost přispívá k šíření AIDS. Výskyt HIV každoročně roste. Podle WHO bylo v letech 1980 až 2000 virem HIV nakaženo 58 milionů lidí. Jen v roce 2000 bylo na celém světě nakaženo 5,3 milionu lidí a 3 miliony lidí na AIDS zemřely. K 1. lednu 2004 bylo v Rusku registrováno 264 tisíc lidí nakažených HIV. Polovina lidí nakažených HIV zemřela do 11–12 let od okamžiku infekce. Na začátku roku 2004 žilo z každých 100 tisíc občanů Ruska přibližně 180 s diagnózou „HIV infekce“. Předpokládá se, že při této úrovni morbidity bude celkový počet lidí nakažených HIV v Rusku do roku 2012 2,5–3 miliony lidí. Složitost boje proti infekci HIV závisí na řadě důvodů: za prvé, neexistují účinné metody její léčby a specifické prevence; za druhé, inkubační doba infekce HIV může překročit 10 let. Jeho trvání závisí na okamžiku aktivace T-lymfocytu a DNA proviru obsaženého v jeho chromozomu. Stále není jasné, zda je každý, kdo je virem nakažený, odsouzen k AIDS, nebo zda je možné dlouhodobé nosičství viru bez onemocnění (což se zdá nepravděpodobné). Konečně existuje několik virů lidské imunodeficience (HIV-1, HIV-2), jejichž antigenní rozdíly brání vzniku zkřížené imunity. Objev viru opičí imunodeficience (SIV) osvětlil otázku původu HIV. SIV je podobný HIV co do organizace genomu, ale významně se liší nukleotidovou sekvencí. HIV-2 zaujímá mezi HIV-1 a SIV co do sérologických vlastností a je SIV bližší co do nukleotidové sekvence. V. M. Ždanov v tomto ohledu navrhl, že viry HIV-1, HIV-2 a SIV pocházejí ze společného předka. Podle R. Galla je možné, že jeden z virů SIV se nějakým způsobem dostal do lidského těla, kde prodělal sérii mutací, což vedlo ke vzniku HIV-1, HIV-2 a jeho dalších forem.
Příznaky HIV infekce
Virus lidské imunodeficience má některé vlastnosti, které do značné míry určují patogenezi onemocnění. Virus má velmi vysokou míru reprodukce, která je dána jeho regulačními prvky (v aktivní fázi je syntetizováno až 5 000 virionů za 5 minut). Díky přítomnosti fúzního proteinu (gp41) virus indukuje tvorbu rozsáhlých syncytiálních struktur v důsledku fúze infikovaných a neinfikovaných T-helperů, což vede k jejich hromadné smrti. Molekuly proteinu gpl20, které se tvoří ve velkém množství, volně cirkulují v krvi a vážou se na receptory neinfikovaných T-helperů, v důsledku čehož jsou také rozpoznávány a ničeny T-killery. Virus se může šířit mezibuněčnými kanály z buňky do buňky, v takovém případě se stává obtížně dostupným pro protilátky.
Klinická kritéria pro HIV infekci
U dospělých je HIV infekce diagnostikována, pokud mají alespoň dva závažné příznaky v kombinaci s alespoň jedním méně závažným příznakem a pokud nejsou přítomny jiné známé příčiny imunodeficience (rakovina, vrozená imunodeficience, silné hladovění atd.). Mezi závažné příznaky patří:
- úbytek hmotnosti o 10 % nebo více;
- prodloužený horečnatý stav, přerušovaný nebo trvalý;
- chronický průjem.
Méně závažné příznaky: přetrvávající kašel, generalizovaná dermatitida, recidivující herpes zoster, orální a faryngeální kandidóza, chronický herpes simplex, generalizovaná lymfadenopatie. Diagnóza AIDS se stanoví pouze při přítomnosti Kaposiho sarkomu, kryptokokové meningitidy, pneumocystické pneumonie. Klinický obraz onemocnění je ovlivněn doprovodnou oportunní infekcí.
Metody kultivace viru lidské imunodeficience (HIV)
HIV-1 a HIV-2 lze kultivovat v buňkách pouze jednoho klonu lymfocytů TCV4 - H9, získaného z leukemických lymfocytů TCV4. Pro tyto účely lze také použít monovrstvé kultury astrocytových buněk, ve kterých se HIV-1 dobře množí. Mezi zvířaty jsou k HIV-1 náchylní šimpanzi.
Rezistence viru ve vnějším prostředí je nízká. Pod vlivem slunečního záření a UV záření hyne, při 80 °C je zničen během 30 minut, při ošetření běžně používanými dezinfekčními prostředky - během 20-30 minut. K dezinfekci materiálu obsahujícího virus je nutné použít mykobaktericidní dezinfekční prostředky, protože jsou účinné proti mikroorganismům s nejvyšší rezistencí.
Laboratorní diagnostika HIV infekce
Hlavní metodou diagnostiky nosičství viru a HIV infekce je enzymatický imunotest. Vzhledem k tomu, že gpl20 má strukturální a antigenní podobnost s receptory některých lidských buněk, včetně receptorů, které transportují imunoglobuliny přes epiteliální buňky sliznic, se však v těle mohou objevit protilátky příbuzné protilátkám proti gpl20. V tomto případě se mohou vyskytnout falešně pozitivní výsledky ELISA. Proto se všechna pozitivně reagující séra subjektů podrobují další analýze pomocí imunoblotovací metody neboli Western blotování. Tato metoda je založena na identifikaci studovaných protilátek po jejich elektroforetické separaci a následném testování pomocí značených anti-specifických protilátek. Virologická metoda se používá zřídka kvůli složitosti kultivace viru. Klon lymfocytů H9 se používá k získání virových antigenů – nezbytných součástí diagnostických testovacích systémů. Metoda CPR umožňuje detekci viru v rané fázi virémie.
Léčba HIV infekce
Je nutné najít nebo syntetizovat léky, které účinně potlačují aktivitu reverzní transkriptázy (revertázy) nebo virové proteázy. Tyto léky by zabránily tvorbě DNA proviru a/nebo inhibovaly intracelulární reprodukci viru. Moderní strategie léčby pacientů infikovaných HIV je založena na principu kombinovaného užívání léků inhibujících virovou proteázu (jeden z léků) a reverzní proteázu (2 různé léky) - kombinovaná (trojitá) terapie. V Rusku se pro léčbu pacientů infikovaných HIV doporučuje kombinované užívání 2 domácích léků: fosfazidu a kriksivanu, které specificky potlačují reprodukci HIV v raných a pozdních fázích reprodukce, zejména při snížené aktivitě azidothymidinu.
Problém specifické profylaxe spočívá v potřebě vytvořit vakcínu, která by zajistila vznik účinné buněčné imunity založené na virově specifických cytotoxických lymfocytech bez jakékoli významné produkce protilátek. Takovou imunitu zajišťují Thl pomocné proteiny. Je možné, že protilátky, včetně protilátek neutralizujících virus, jsou nejen neúčinné při potlačování HIV infekce, ale ve vysoké míře potlačují buněčnou imunitu. Proto musí vakcína proti HIV splňovat především dva hlavní požadavky: a) být absolutně bezpečná a b) stimulovat aktivitu T-cytotoxických lymfocytů. Studuje se účinnost různých variant vakcíny získaných z usmrcených (inaktivovaných) virů a z jednotlivých antigenů s vysokými ochrannými vlastnostmi. Takové antigeny lze buď izolovat ze samotných virionů, nebo chemicky syntetizovat. Byla navržena vakcína vytvořená na základě metod genetického inženýrství. Jedná se o rekombinantní virus vakcínie nesoucí geny HIV zodpovědné za syntézu antigenů se silnými imunogenními vlastnostmi. Otázka účinnosti těchto vakcín vyžaduje značný čas vzhledem k dlouhé inkubační době HIV infekce a vysoké variabilitě patogenu. Vytvoření vysoce účinné vakcíny proti HIV je naléhavým zásadním problémem.

