Lékařský expert článku
Nové publikace
Příštítná tělíska
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
V roce 1879 švédský vědec S. Sandstrom popsal příštítná tělíska u lidí a dal jim jméno. Příštítná tělíska jsou životně důležité orgány. Jejich funkcí je produkovat a vylučovat parathormon (PTH), jeden z hlavních regulátorů metabolismu vápníku a fosforu.
Párová horní a dolní příštítná tělíska (glandula parathyroidea superior) a dolní příštítná tělíska (glandula parathyroidea inferior) jsou kulatá nebo vejčitá tělíska umístěná na zadní ploše každého z laloků štítné žlázy: jedna žláza nahoře, druhá dole. Délka každé žlázy je 4-8 mm, šířka 3-4 mm a tloušťka 2-3 mm. Počet těchto žláz není konstantní a může se pohybovat od 2 do 7-8, v průměru jsou čtyři. Celková hmotnost žláz je v průměru 1,18 g.
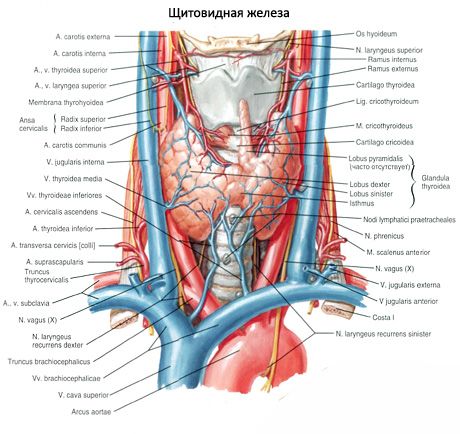
Příštítná tělíska se od štítné žlázy liší světlejší barvou (u dětí jsou světle růžová, u dospělých žlutohnědá). Často se příštítná tělíska nacházejí v místě pronikání dolních štítných tepen nebo jejich větví do tkáně štítné žlázy. Příštítná tělíska jsou od okolních tkání oddělena vlastním vláknitým pouzdrem, z něhož do žláz vystupují vrstvy pojivové tkáně. Ty obsahují velké množství cév a dělí příštítná tělíska do skupin epiteliálních buněk.
Parenchym žláz je tvořen hlavními a acidofilními paratyrocyty, které tvoří provazce a shluky obklopené tenkými svazky vláken pojivové tkáně. Oba typy buněk jsou považovány za různá stádia vývoje paratyrocytů. Hlavní paratyrocyty mají polyedrický tvar, bazofilní cytoplazmu s velkým počtem ribozomů. Mezi těmito buňkami se rozlišují tmavé (aktivně sekreční) a světlé (méně aktivní). Acidofilní paratyrocyty jsou velké, s jasnými konturami, obsahují mnoho malých mitochondrií s částicemi glykogenu.
Hormon příštítných tělísek, paratyroxin (parathormon), má bílkovinné složení a podílí se na regulaci metabolismu fosforu a vápníku. Parathormon snižuje vylučování vápníku močí a zvyšuje jeho vstřebávání ve střevě za přítomnosti vitaminu D. Thyrokalcitonin je antagonista parathormonu.
Embryogeneze příštítných tělísek
Příštítná tělíska se vyvíjejí z epitelu párových III. a IV. žaberních kapes. V 7. týdnu vývoje se epitelové rudimenty těl oddělují od stěn žaberních kapes a v procesu růstu se pohybují kaudálním směrem. Následně pro ně zaujímají formující se příštítná tělíska trvalou pozici na zadních plochách pravého a levého laloku štítné žlázy.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Cévy a nervy příštítných tělísek
Přípravek příštítných tělísek krve je zajištěn větvemi horní a dolní štítné tepny, stejně jako jícnovými a tracheálními větvemi. Žilní krev odtéká ven stejnojmennými žilami. Inervace příštítných tělísek je podobná inervaci štítné žlázy.
Věkem podmíněné rysy příštítných tělísek
Celková hmotnost příštítných tělísek u novorozence kolísá mezi 6 a 9 mg. Během prvního roku života se jejich celková hmotnost zvětší 3–4krát, do 5 let se opět zdvojnásobí a do 10 let se ztrojnásobí. Po 20 letech celková hmotnost čtyř příštítných tělísek dosahuje 120–140 mg a zůstává konstantní až do stáří. Ve všech věkových kategoriích je hmotnost příštítných tělísek u žen o něco větší než u mužů.
Člověk má obvykle dva páry příštítných tělísek (horní a dolní), které se nacházejí na zadní straně štítné žlázy, vně jejího pouzdra, poblíž horního a dolního pólu. Počet a lokalizace příštítných tělísek se však může lišit; někdy se jich nachází až 12. Mohou být umístěny v tkáni štítné žlázy a brzlíku, v předním a zadním mediastinu, v osrdečníku, za jícnem, v oblasti bifurkace karotické tepny. Horní příštítná tělíska mají tvar zploštělého vejčitého tvaru, dolní jsou kulatá. Jejich rozměry jsou přibližně od 6x3 do 4x1,5 - 3 mm, celková hmotnost je od 0,05 do 0,5 g, barva je načervenalá nebo žlutohnědá. Prokrvení příštítných tělísek je zajištěno převážně větvemi dolní štítné tepny, žilní odtok probíhá žilami štítné žlázy, jícnu a průdušnice. Příštítná tělíska jsou inervována sympatickými vlákny rekurentního a horního laryngeálního nervu, parasympatickou inervaci zajišťují bloudivé nervy. Příštítná tělíska jsou pokryta tenkým pouzdrem pojivové tkáně; septa, která z ní vybíhají, pronikají do žláz. Obsahují krevní cévy a nervová vlákna. Parenchym příštítných tělísek se skládá z paratyrocytů neboli hlavních buněk, mezi nimiž se podle stupně zabarvení rozlišují hormonálně aktivní světlé nebo lesklé buňky a také klidové tmavé buňky. Hlavní buňky tvoří shluky, provazce a trsy a u starších osob folikuly s koloidem v dutině. U dospělých se objevují buňky, umístěné převážně podél obvodu příštítných tělísek, barvené eosinem - eozinofilní nebo oxyfilní buňky, což jsou degenerující hlavní buňky. V příštítných tělíscích lze nalézt i přechodné formy mezi hlavními a oxyfilními buňkami.
Prvních úspěchů v objasňování otázek syntézy, dekódování struktury a studiu metabolismu parathormonu bylo dosaženo po roce 1972. Parathormon je jednořetězcový polypeptid sestávající z 84 aminokyselinových zbytků, zbavený cysteinu, s molekulovou hmotností přibližně 9500 daltonů, tvořený v příštítných tělíscích z bioprekurzoru - proparathormonu (proPTH), který má na NH2 konci dalších 6 aminokyselin. ProPTH je syntetizován v hlavních buňkách příštítných tělísek (v jejich granulárním endoplazmatickém retikulu) a v procesu proteolytického štěpení v Golgiho aparátu se přeměňuje na parathormon. Jeho biologická aktivita je výrazně nižší než aktivita PTH. ProPTH zřejmě v krvi zdravých lidí chybí, ale za patologických stavů (s adenomem příštítných tělísek) se může vylučovat do krve spolu s PTH. Nedávno byl objeven prekurzor proPTH, preproPTH, který obsahuje dalších 25 aminokyselinových zbytků na NH2-konci. PreproPTH tedy obsahuje 115 aminokyselinových zbytků, proPTH 90 a PTH 84.
Struktura bovinního a prasečího parathormonu je nyní plně objasněna. Lidský parathormon byl izolován z adenomů příštítných tělísek, ale jeho struktura byla rozluštěna pouze částečně. Ve struktuře parathormonu existují rozdíly, ale zvířecí a lidské parathormony vykazují zkříženou imunoreaktivitu. Polypeptid sestávající z prvních 34 aminokyselinových zbytků si prakticky zachovává biologickou aktivitu přirozeného hormonu. To nám umožňuje předpokládat, že zbývajících téměř % molekuly na karboxylovém konci přímo nesouvisí s hlavními účinky parathormonu. Fragment 1-29 parathormonu také vykazuje určitou biologickou a imunologickou aktivitu. Biologicky neaktivní fragment 53-84 také vykazuje imunologický účinek, tj. tyto vlastnosti parathormonu vykazují alespoň 2 úseky jeho molekuly.
Parathormon cirkulující v krvi je heterogenní a liší se od nativního hormonu vylučovaného příštítnými tělísky. V krvi se rozlišují nejméně tři různé typy parathormonu: intaktní parathormon s molekulovou hmotností 9 500 daltonů; biologicky neaktivní látky z karboxylové části molekuly parathormonu s molekulovou hmotností 7 000–7 500 daltonů; biologicky aktivní látky s molekulovou hmotností přibližně 4 000 daltonů.
V žilní krvi byly nalezeny ještě menší fragmenty, což naznačuje, že se tvořily na periferii. Hlavními orgány, kde se fragmenty parathormonu tvořily, byla játra a ledviny. Fragmentace parathormonu v těchto orgánech byla zvýšena při patologii jater a chronickém selhání ledvin (CRF). Za těchto podmínek zůstávaly fragmenty parathormonu v krevním řečišti výrazně déle než u zdravých jedinců. Játra absorbovala převážně intaktní parathormon, ale neodstraňovala z krve ani karboxy-terminální, ani amino-terminální fragmenty parathormonu. Ledviny hrály hlavní roli v metabolismu parathormonu. Podílely se na téměř 60 % metabolické clearance karboxy-terminálního imunoreaktivního hormonu a 45 % amino-terminálního fragmentu parathormonu. Hlavní oblastí metabolismu aktivního amino-terminálního fragmentu parathormonu byly kosti.
Byla zjištěna pulzující sekrece parathormonu, nejintenzivnější v noci. Po 3-4 hodinách od začátku nočního spánku je jeho obsah v krvi 2,5-3krát vyšší než průměrná denní hladina.
Hlavní funkcí parathormonu je udržování homeostázy vápníku. Současně je sérový vápník (celkový a zejména ionizovaný) hlavním regulátorem sekrece parathormonu (snížení hladiny vápníku stimuluje sekreci parathormonu, zatímco zvýšení ji potlačuje), tj. regulace probíhá na principu zpětné vazby. Za podmínek hypokalcemie se zvyšuje přeměna proPTH na parathormon. Důležitou roli při uvolňování parathormonu hraje také obsah hořčíku v krvi (jeho zvýšená hladina stimuluje, zatímco snížená hladina sekreci parathormonu potlačuje). Hlavními cíli parathormonu jsou ledviny a kosterní kosti, ale vliv parathormonu na vstřebávání vápníku ve střevě, toleranci sacharidů, hladinu lipidů v séru, jeho role při rozvoji impotence, svědění kůže atd.
Pro charakterizaci vlivu parathormonu na kosti je nutné poskytnout stručné informace o struktuře kostní tkáně, vlastnostech její fyziologické resorpce a remodelace.
Je známo, že převážná část vápníku v těle (až 99 %) je obsažena v kostní tkáni. Vzhledem k tomu, že se v kostech nachází ve formě sloučenin fosforu a vápníku, nachází se v kostech také % celkového obsahu fosforu. Jejich tkáň se i přes svou zdánlivou statickou povahu neustále remodeluje, aktivně vaskularizuje a má vysoké mechanické vlastnosti. Kost je dynamickým „depotem“ fosforu, hořčíku a dalších sloučenin nezbytných pro udržení homeostázy v minerálním metabolismu. Její struktura zahrnuje husté minerální složky, které úzce souvisejí s organickou matricí, která se skládá z 90–95 % z kolagenu, malého množství mukopolysacharidů a nekolagenních proteinů. Minerální část kosti se skládá z hydroxyapatitu – jeho empirický vzorec je Ca10(PO4)6(OH)2 – a amorfního fosforečnanu vápenatého.
Kost je tvořena osteoblasty pocházejícími z nediferencovaných mezenchymových buněk. Jedná se o mononukleární buňky zapojené do syntézy složek organické kostní matrix. Jsou umístěny v monovrstvě na povrchu kosti a jsou v těsném kontaktu s osteoidem. Osteoblasty jsou zodpovědné za ukládání osteoidu a jeho následnou mineralizaci. Produktem jejich životně důležité činnosti je alkalická fosfatáza, jejíž obsah v krvi je nepřímým ukazatelem jejich aktivity. Obklopeny mineralizovaným osteoidem se některé osteoblasty mění na osteocyty - mononukleární buňky, jejichž cytoplazma tvoří kanálky spojené s kanálky sousedních osteocytů. Neúčastní se remodelace kosti, ale podílejí se na procesu perilakunární destrukce, což je důležité pro rychlou regulaci hladiny vápníku v krevním séru. Resorpce kosti je prováděna osteoklasty - obřími polynukleárními buňkami, zřejmě vzniklými fúzí mononukleárních makrofágů. Předpokládá se také, že prekurzory osteoklastů mohou být hematopoetické kmenové buňky kostní dřeně. Jsou mobilní, tvoří vrstvu v kontaktu s kostí, nacházející se v oblastech její největší resorpce. V důsledku uvolňování proteolytických enzymů a kyselé fosfatázy způsobují osteoklasty degradaci kolagenu, destrukci hydroxyapatitu a odstraňování minerálů z matrix. Nově vytvořená špatně mineralizovaná kostní tkáň (osteoid) je rezistentní vůči osteoklastické resorpci. Funkce osteoblastů a osteoklastů jsou nezávislé, ale vzájemně koordinované, což vede k normální remodelaci skeletu. Růst kostí do délky závisí na endochondrální osifikaci, růst do šířky a tloušťky - na periostální osifikaci. Klinické studie s 47 Ca prokázaly, že až 18 % celkového obsahu vápníku ve skeletu se obnovuje každý rok. Při poškození kostí (zlomeniny, infekční procesy) se změněná kost resorbuje a vzniká nová kost.
Buněčné komplexy zapojené do lokálního procesu resorpce a tvorby kostí se nazývají základní mnohobuněčné remodelační jednotky (BMU). Regulují lokální koncentraci vápníku, fosforu a dalších iontů, syntézu organických složek kosti, zejména kolagenu, její organizaci a mineralizaci.
Hlavním účinkem parathormonu v kostech skeletu je posílení resorpčních procesů, které ovlivňují jak minerální, tak organické složky kostní struktury. Parathormon podporuje růst osteoklastů a jejich aktivitu, což je doprovázeno zvýšeným osteolytickým účinkem a zvýšením resorpce kostí. V tomto případě se krystaly hydroxyapatitu rozpouštějí za uvolňování vápníku a fosforu do krve. Tento proces je hlavním mechanismem pro zvýšení hladiny vápníku v krvi. Skládá se ze tří složek: mobilizace vápníku z perilakunární kosti (hluboké osteocyty); proliferace osteoprogeneračních buněk do osteoklastů; udržování konstantní hladiny vápníku v krvi regulací jeho uvolňování z kosti (povrchové osteocyty).
Parathormon tedy zpočátku zvyšuje aktivitu osteocytů a osteoklastů, čímž zvyšuje osteolýzu a způsobuje zvýšení hladiny vápníku v krvi a zvýšené vylučování vápníku a oxyprolinu močí. Toto je první, kvalitativní, rychlý účinek parathormonu. Druhý účinek parathormonu na kosti je kvantitativní. Je spojen se zvýšením zásoby osteoklastů. Při aktivní osteolýze dochází ke stimulaci zvýšené proliferace osteoblastů, aktivuje se resorpce i tvorba kostí s převahou resorpce. Při nadbytku parathormonu dochází k negativní kostní bilanci. To je doprovázeno nadměrným vylučováním oxyprolinu - produktu degradace kolagenu a sialových kyselin, které jsou součástí struktury mukopolysacharidů. Parathormon aktivuje cyklický adenosinmonofosfát (cAMP). Zvýšené vylučování cAMP močí po podání parathormonu může sloužit jako indikátor citlivosti tkání na něj.
Nejdůležitějším účinkem parathormonu na ledviny je jeho schopnost snižovat reabsorpci fosforu a zvyšovat fosfaturii. Mechanismus redukce v různých částech nefronu je odlišný: v proximální části je tento účinek parathormonu způsoben zvýšenou propustností a probíhá za účasti cAMP, zatímco v distální části na cAMP nezávisí. Fosfaturický účinek parathormonu se mění s nedostatkem vitaminu D, metabolickou acidózou a sníženým obsahem fosforu. Parathormony mírně zvyšují celkovou tubulární reabsorpci vápníku. Zároveň ji snižují v proximálních částech a zvyšují v distálních částech. Dominantní význam má ta druhá - parathormon snižuje clearance vápníku. Parathormon snižuje tubulární reabsorpci sodíku a jeho bikarbonátu, což může vysvětlovat rozvoj acidózy při hyperparatyreóze. Zvyšuje tvorbu 1,25-dioxycholekalciferolu 1,25(OH2 ) D3 v ledvinách - aktivní formy vitaminu D3. Tato sloučenina zvyšuje reabsorpci vápníku v tenkém střevě stimulací aktivity specifického proteinu vázajícího vápník (CaBP) v jeho stěně.
Normální hladina parathormonu je v průměru 0,15-0,6 ng/ml. Liší se v závislosti na věku a pohlaví. Průměrný obsah parathormonu v krvi osob ve věku 20-29 let je (0,245±0,017) ng/ml, 80-89 let - (0,545±0,048) ng/ml; hladina parathormonu u 70letých žen je (0,728±0,051) ng/ml, u mužů stejného věku - (0,466±0,40) ng/ml. Obsah parathormonu tedy s věkem roste, ale ve větší míře u žen.
Pro diferenciální diagnostiku hyperkalcémie by se zpravidla mělo použít několik různých testů.
Předkládáme klinickou a patogenetickou klasifikaci, kterou jsme vyvinuli na základě klasifikace O. V. Nikolajeva a V. N. Tarkajevové (1974).
Klinická a patogenetická klasifikace onemocnění spojených se zhoršenou sekrecí parathormonu a citlivostí na něj
Primární hyperparatyreóza
- Patogenezí:
- hyperfunkční adenom(y);
- hyperplazie OGD;
- hyperfunkční karcinom příštítných tělísek;
- mnohočetná endokrinní neoplazie typu I s hyperparatyreózou (Wermerův syndrom);
- mnohočetná endokrinní neoplazie typu II s hyperparatyreózou (Sippleův syndrom).
- Podle klinických příznaků:
- kostní forma:
- osteoporotický,
- fibrocystická osteitida,
- „Pagetoid“;
- visceropatická forma:
- s převažujícím poškozením ledvin, gastrointestinálního traktu, neuropsychiatrické sféry;
- smíšená forma.
- kostní forma:
- Po proudu:
- pikantní;
- chronický.
Sekundární hyperparatyreóza (sekundární hyperfunkce a hyperplazie příštítných tělísek s prodlouženou hypokalcemií a hyperfosfatemií)
- Patologie ledvin:
- chronické selhání ledvin;
- tubulopatie (typu Albright-Fanconiho);
- renální křivice.
- Střevní patologie:
- malabsorpční syndrom.
- Patologie kostí:
- stařecká osteomalacie;
- šestinedělí;
- idiopatický;
- Pagetova choroba.
- Nedostatek vitaminu D:
- onemocnění ledvin;
- játra;
- dědičné nedostatky enzymů.
- Zhoubná onemocnění: myelom.
Terciární hyperparatyreóza
- Autonomně fungující adenom(y) příštítných tělísek, vyvíjející se na pozadí dlouhodobé sekundární hyperparatyreózy.
Pseudohyperparatyreóza
- Produkce parathormonu nádory jiného než příštítných tělísek.
Hormonálně neaktivní cystické a nádorové formace příštítných tělísek
- Cysta.
- Hormonálně neaktivní nádory nebo karcinom.
Hypoparatyreóza
- Vrozené nedostatečné vývojové stavy nebo absence příštítných tělísek.
- Idiopatický, autoimunitní původ.
- Pooperační, vyvinutý v souvislosti s odstraněním příštítných tělísek.
- Pooperační období z důvodu zhoršeného krevního zásobení a inervace.
- Radiační poškození, exogenní a endogenní (zevní radioterapie, léčba onemocnění štítné žlázy radioaktivním jódem).
- Poškození příštítných tělísek v důsledku krvácení nebo infarktu.
- Infekční léze.
Pseudohypoparatyreóza
- Typ I - necitlivost cílových orgánů na parathormon, závislá na adenylátcykláze;
- Typ II - necitlivost cílových orgánů na parathormon, nezávislá na adenylátcykláze, pravděpodobně autoimunitního původu.
Pseudopseudohypoparatyreóza
Přítomnost somatických známek pseudohypoparatyreózy u zdravých příbuzných v rodinách pacientů s pseudohypoparatyreózou bez charakteristických biochemických poruch a bez tetanie.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

