Lékařský expert článku
Nové publikace
Hematoencefalická bariéra
Naposledy posuzováno: 07.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Hematoencefalická bariéra je nesmírně důležitá pro zajištění homeostázy mozku, ale mnoho otázek týkajících se jejího vzniku dosud nebylo plně objasněno. Již nyní je však jasné, že hematoencefalická bariéra (HBB) je nejdiferencovanější, nejkomplexnější a nejhustší histohematickou bariérou. Její hlavní strukturální a funkční jednotkou jsou endotelové buňky mozkových kapilár.
Metabolismus mozku, stejně jako žádný jiný orgán, závisí na látkách vstupujících do krevního oběhu. Četné cévy, které zajišťují fungování nervového systému, se vyznačují tím, že proces pronikání látek skrz jejich stěny je selektivní. Endotelové buňky kapilár mozku jsou vzájemně propojeny nepřetržitými těsnými kontakty, takže látky mohou procházet pouze skrz samotné buňky, nikoli mezi nimi. Gliové buňky, druhá složka hematoencefalické bariéry, sousedí s vnějším povrchem kapilár. V cévních plexech mozkových komor je anatomickým základem bariéry epiteliální buňky, které jsou také vzájemně pevně propojeny. V současné době se hematoencefalická bariéra nepovažuje za anatomický a morfologický útvar schopný selektivně procházet a v některých případech i doručovat různé molekuly do nervových buněk pomocí mechanismů aktivního transportu. Bariéra tak plní regulační a ochranné funkce.
V mozku existují struktury, kde je hematoencefalická bariéra oslabena. Jedná se především o hypotalamus, dále o řadu struktur na dně 3. a 4. komory – nejzadnější pole (area postrema), subfornikální a subkomisurální orgány a šišinku mozkovou. Integrita hematoencefalické bariéry je narušena u ischemických a zánětlivých mozkových lézí.
Hematoencefalická bariéra se považuje za plně vytvořenou, když vlastnosti těchto buněk splňují dvě podmínky. Zaprvé, rychlost endocytózy v kapalné fázi (pinocytózy) v nich musí být extrémně nízká. Zadruhé, mezi buňkami se musí tvořit specifické těsné spojení, které se vyznačují velmi vysokým elektrickým odporem. Ten dosahuje hodnot 1000-3000 Ohm/cm2 pro kapiláry pia mater a 2000 až 8000 0 m/cm2 pro intraparenchymální mozkové kapiláry. Pro srovnání: průměrná hodnota transendoteliálního elektrického odporu kapilár kosterního svalstva je pouze 20 Ohm/cm2.
Propustnost hematoencefalické bariéry pro většinu látek je do značné míry určena jejich vlastnostmi a také schopností neuronů tyto látky syntetizovat samostatně. Mezi látky, které dokáží tuto bariéru překonat, patří v první řadě kyslík a oxid uhličitý, dále různé kovové ionty, glukóza, esenciální aminokyseliny a mastné kyseliny nezbytné pro normální funkci mozku. Glukóza a vitamíny jsou transportovány pomocí nosičů. Zároveň mají D- a L-glukóza různou rychlost průniku bariérou - první z nich je více než 100krát vyšší. Glukóza hraje hlavní roli jak v energetickém metabolismu mozku, tak v syntéze řady aminokyselin a proteinů.
Hlavním faktorem určujícím fungování hematoencefalické bariéry je úroveň metabolismu nervových buněk.
Zásobování neuronů potřebnými látkami se provádí nejen pomocí krevních kapilár, které k nim přistupují, ale také díky výběžkům měkké a pavučinové membrány, kterými cirkuluje mozkomíšní mok. Mozkomíšní mok se nachází v lebeční dutině, v mozkových komorách a v prostorech mezi mozkovými membránami. U lidí je jeho objem asi 100-150 ml. Díky mozkomíšnímu moku se udržuje osmotická rovnováha nervových buněk a odstraňují se metabolické produkty toxické pro nervovou tkáň.
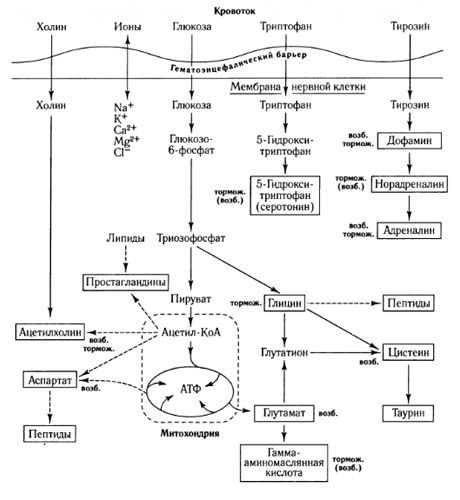
Dráhy výměny mediátorů a role hematoencefalické bariéry v metabolismu (dle: Shepherd, 1987)
Průchod látek hematoencefalickou bariérou závisí nejen na propustnosti cévní stěny pro ně (molekulová hmotnost, náboj a lipofilita látky), ale také na přítomnosti nebo nepřítomnosti aktivního transportního systému.
Stereospecifický inzulín-nezávislý transportér glukózy (GLUT-1), který zajišťuje přenos této látky přes hematoencefalickou bariéru, je hojně zastoupen v endotelových buňkách mozkových kapilár. Aktivita tohoto transportéru může zajistit dodání glukózy v množství 2–3krát větším, než jaké mozek potřebuje za normálních podmínek.
Charakteristika transportních systémů hematoencefalické bariéry (dle: Pardridge, Oldendorf, 1977)
Přenosné |
Preferenční substrát |
Km, mm |
Vmax |
Hexózy |
Glukóza |
9 |
1600 |
Monokarboxylové |
Laktát |
1,9 |
120 |
Neutrální |
Fenylalanin |
0,12 |
30 |
Esenciální |
Lysin |
0,10 |
6 |
Aminy |
Cholin |
0,22 |
6 |
Puriny |
Adenin |
0,027 |
1 |
Nukleosidy |
Adenosin |
0,018 |
0,7 |
U dětí s poruchou funkce tohoto transportéru dochází k významnému poklesu hladiny glukózy v mozkomíšním moku a k poruchám vývoje a fungování mozku.
Monokarboxylové kyseliny (L-laktát, acetát, pyruvát) a ketonová tělíska jsou transportovány oddělenými stereospecifickými systémy. Přestože je jejich intenzita transportu nižší než u glukózy, jsou důležitým metabolickým substrátem u novorozenců a během hladovění.
Transport cholinu do centrálního nervového systému je také zprostředkován tímto transportérem a může být regulován rychlostí syntézy acetylcholinu v nervovém systému.
Vitamíny nejsou syntetizovány mozkem a jsou dodávány z krve pomocí speciálních transportních systémů. Přestože tyto systémy mají relativně nízkou transportní aktivitu, za normálních podmínek dokáží zajistit transport množství vitamínů nezbytných pro mozek, ale jejich nedostatek v potravě může vést k neurologickým poruchám. Některé plazmatické proteiny mohou také pronikat hematoencefalickou bariérou. Jedním ze způsobů jejich průniku je receptorem zprostředkovaná transcytóza. Takto bariérou pronikají inzulin, transferin, vasopresin a inzulinu podobný růstový faktor. Endotelové buňky mozkových kapilár mají pro tyto proteiny specifické receptory a jsou schopny endocytózu komplexu protein-receptor. Důležité je, že v důsledku následných událostí se komplex rozpadne, intaktní protein se může uvolnit na opačné straně buňky a receptor se může opět integrovat do membrány. Pro polykationtové proteiny a lektiny je transcytóza také způsobem průniku hematoencefalickou bariérou, ale není spojena s prací specifických receptorů.
Mnoho neurotransmiterů přítomných v krvi není schopno proniknout hematoencefalickou bariérou (HBB). Dopamin tedy tuto schopnost nemá, zatímco L-DOPA proniká HBB pomocí systému transportu neutrálních aminokyselin. Kapilární buňky navíc obsahují enzymy, které metabolizují neurotransmitery (cholinesterázu, GABA transaminázu, aminopeptidázy atd.), léky a toxické látky, což zajišťuje ochranu mozku nejen před neurotransmitery cirkulujícími v krvi, ale také před toxiny.
Práce BBB zahrnuje také transportní proteiny, které transportují látky z endotelových buněk mozkových kapilár do krve a brání jejich pronikání do mozku, například b-glykoprotein.
Během ontogeneze se rychlost transportu různých látek přes hematologickou bariéru (HBB) významně mění. Rychlost transportu b-hydroxybutyrátu, tryptofanu, adeninu, cholinu a glukózy je tedy u novorozenců výrazně vyšší než u dospělých. To odráží relativně vyšší potřebu energie a makromolekulárních substrátů vyvíjejícího se mozku.


 [
[