Lékařský expert článku
Nové publikace
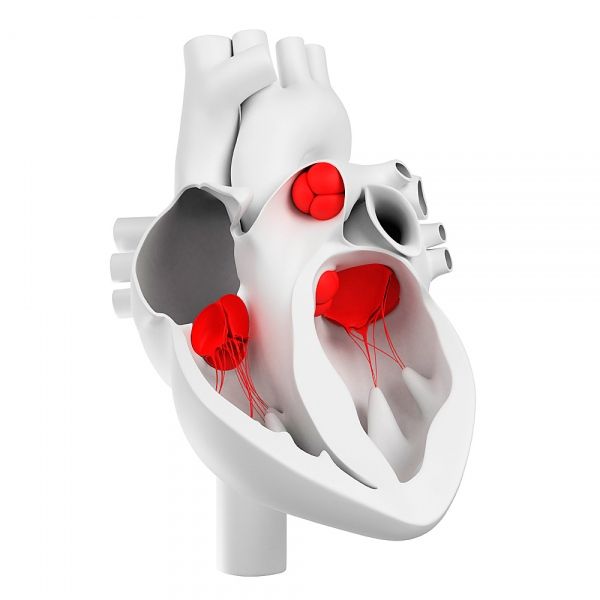
Srdeční chlopně
Naposledy posuzováno: 04.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Dříve se věřilo, že všechny srdeční chlopně jsou jednoduché struktury, jejichž příspěvek k jednosměrnému průtoku krve spočívá v pasivním pohybu v reakci na aplikovaný tlakový gradient. Toto pochopení „pasivních struktur“ vedlo k vývoji „pasivních“ mechanických a biologických náhrad chlopní.
Nyní je zřejmé, že srdeční chlopně mají složitější strukturu a funkci. Proto vytvoření „aktivní“ náhrady srdeční chlopně předpokládá významnou podobnost struktury a funkce s přirozenou srdeční chlopní, což je v budoucnu díky rozvoji tkáňového inženýrství zcela reálné.
Srdeční chlopně se vyvíjejí z embryonálních rudimentů mezenchymální tkáně během formování endokardu. Během morfogeneze se tvoří atrioventrikulární kanál (trikuspidální a mitrální srdeční chlopně) a ventrikulární výtokový trakt (aortální a plicní srdeční chlopně).
Jak jsou uspořádány srdeční chlopně?
Studium krevního zásobení chlopní zahájil N. Luschka (1852), který do srdečních cév injekčně aplikoval kontrastní látku. Objevil četné krevní cévy v cípcích atrioventrikulárních a semilunárních chlopní aorty a plicní tepny. Současně řada příruček o patologické anatomii a histologii obsahovala údaje o tom, že nezměněné lidské srdeční chlopně neobsahují krevní cévy a ty se v chlopních objevují pouze při různých patologických procesech - ateroskleróze a endokarditidě různých etiologií. Informace o absenci krevních cév byly založeny především na histologických studiích. Předpokládalo se, že při absenci krevních cév ve volné části cípů dochází k jejich výživě filtrací tekutiny z krevní plazmy omývající cípy. Byla zaznamenána penetrace několika cév spolu s vlákny pruhované svaloviny do bází chlopní a šlachových strun.
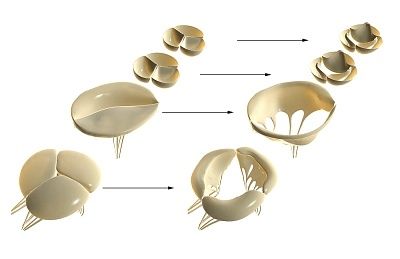
Při injekčním podávání různých barviv (tuš v želatině, vizmut v želatině, vodná suspenze černého tuše, roztoky karmínu nebo trypanové modři) do srdečních cév však bylo zjištěno, že cévy pronikají atrioventrikulárními srdečními chlopněmi, aortálními chlopněmi a plicní tepnou spolu s tkání srdečního svalu, těsně před volným okrajem chlopně.
V řídké vláknité pojivové tkáni cípků atrioventrikulární chlopně byly nalezeny jednotlivé hlavní cévy, které anastomovaly s cévami v přilehlých oblastech tkáně srdeční příčně pruhované svaloviny.
Největší počet krevních cév se nacházel na bázi a poměrně menší počet ve volné části těchto chlopní.
Podle K. I. Kulčitského a kol. (1990) se v mitrální chlopni nachází větší průměr arteriálních a žilních cév. Na bázi cípků této chlopně se nacházejí převážně hlavní cévy s úzkou sítí kapilár, pronikající do bazální části cípu a zabírající 10 % jeho plochy. V trikuspidální chlopni mají arteriální cévy menší průměr než v mitrální chlopni. V cípcích této chlopně se nacházejí převážně rozptýlené cévy a poměrně široké smyčky krevních kapilár. V mitrální chlopni je přední cíp zásoben krví intenzivněji, v trikuspidální chlopni přední a zadní cíp, které plní hlavní uzavírací funkci. Poměr průměrů arteriálních a žilních cév v atrioventrikulárních chlopních srdce dospělých lidí je 1:1,5. Kapilární smyčky jsou polygonální a jsou umístěny kolmo k bázi cípků chlopně. Cévy tvoří planární síť umístěnou pod endotelem na straně síní. Krevní cévy se nacházejí také v šlachových chordách, kam pronikají z papilárních svalů pravé a levé komory ve vzdálenosti až 30 % délky šlachových chord. Četné krevní cévy tvoří obloukovité smyčky na bázi šlachových chord. Srdeční chlopně aorty a plicního kmene se od atrioventrikulárních chlopní výrazně liší z hlediska krevního zásobení. Hlavní cévy relativně menšího průměru se blíží k bázi pomilunárních cípů aorty a plicního kmene. Krátké větve těchto cév končí kapilárními smyčkami nepravidelného oválného a polygonálního tvaru. Jsou umístěny převážně v blízkosti báze pomilunárních cípů. Žilní cévy na bázi aortální a plicní chlopně mají také menší průměr než cévy na bázi atrioventrikulárních chlopní. Poměr průměrů arteriálních a žilních cév v aortální a plicní chlopni srdce dospělých lidí je 1:1,4. Z větších cév vybíhají krátké boční větve, které končí smyčkami kapilár nepravidelného oválného a polygonálního tvaru.

S věkem dochází k zhrubnutí vláken pojivové tkáně, a to jak kolagenních, tak elastických, a také ke snížení množství řídké vláknité neformované pojivové tkáně, rozvíjí se skleróza tkáně cípů atrioventrikulárních chlopní a semilunárních cípů aortální a plicní tepny. Délka vláken srdečního pruhovaného svalstva v chlopních se snižuje, a v důsledku toho se snižuje jejich množství a počet cév pronikajících srdečními chlopněmi. V důsledku těchto změn srdeční chlopně ztrácejí své elastické a pružné vlastnosti, což ovlivňuje mechanismus uzavírání chlopní a hemodynamiku.
Srdeční chlopně mají sítě lymfatických kapilár a malý počet lymfatických cév vybavených chlopněmi. Lymfatické kapiláry cípků mají charakteristický vzhled: jejich lumen je velmi nerovnoměrný, stejná kapilára má v různých oblastech různý průměr. V místech, kde se několik kapilár slévá, se tvoří rozšíření - lakuny různých tvarů. Smyčky sítí jsou často nepravidelné polygonální, méně často oválné nebo kulaté. Smyčky lymfatických sítí často nejsou uzavřené a lymfatické kapiláry končí slepě. Smyčky lymfatických kapilár jsou orientovány nejčastěji ve směru od volného okraje cípu k jeho základně. V některých případech byla v cípcích atrioventrikulární chlopně nalezena dvouvrstvá síť lymfatických kapilár.
Endokardiální nervové plexy se nacházejí v jeho různých vrstvách, převážně pod endotelem. Na volném okraji cípků chlopní jsou nervová vlákna umístěna převážně radiálně a spojují se s vlákny šlachových chord. Blíže k bázi cípků se tvoří nervový plexus s velkou sítí, který se spojuje s plexem umístěným kolem vazivových prstenců. Na semilunárních cípcích je endokardiální nervová síť řídší. V místě úponu chlopní se stává hustší a vícevrstvou.
Buněčná struktura srdečních chlopní
Intersticiální buňky chlopní, které jsou zodpovědné za udržování struktury chlopně, mají protáhlý tvar s četnými jemnými výběžky, které se táhnou celou matricí chlopně. Existují dvě populace intersticiálních buněk chlopní, které se liší morfologií a strukturou; jedna má kontraktilní vlastnosti a je charakterizována přítomností kontraktilních fibril, druhá má sekreční vlastnosti a má dobře vyvinuté endoplazmatické retikulum a Golgiho aparát. Kontraktilní funkce odolává hemodynamickému tlaku a je dále podporována produkcí srdečních i kosterních kontraktilních proteinů, které zahrnují těžké řetězce alfa- a beta-myosinu a různé izoformy troponinu. Kontrakce cípu srdeční chlopně byla prokázána v reakci na řadu vazoaktivních látek, což naznačuje koordinovaný biologický stimul pro úspěšnou funkci chlopně.
Intersticiální buňky jsou také nezbytnými součástmi systému opravy struktur, jako jsou srdeční chlopně. Neustálý pohyb chlopňových cípů a s ním spojená deformace pojivové tkáně způsobují poškození, na které reagují intersticiální buňky chlopní, aby se udržela integrita chlopně. Proces opravy se zdá být nezbytný pro normální funkci chlopně a absence těchto buněk v současných modelech umělých chlopní je pravděpodobně faktorem přispívajícím ke strukturálnímu poškození bioprotéz.
Důležitou oblastí výzkumu intersticiálních buněk je studium interakcí mezi nimi a okolní matricí zprostředkovaných molekulami fokální adheze. Fokální adheze jsou specializovaná místa interakce buňka-matrix, která spojují buněčný cytoskelet s proteiny matrixu prostřednictvím integrinů. Fungují také jako místa přenosu signálu, která přenášejí mechanické informace z extracelulární matrix, jež mohou vyvolat reakce, včetně, ale nikoli výhradně, buněčné adheze, migrace, růstu a diferenciace. Pochopení buněčné biologie chlopňových intersticiálních buněk je zásadní pro objasnění mechanismů, kterými tyto buňky interagují mezi sebou navzájem a se svým prostředím, aby bylo možné tuto funkci rekapitulovat v umělých chlopních.
V souvislosti s rozvojem slibného směru tkáňového inženýrství srdečních chlopní se provádějí studie intersticiálních buněk s využitím široké škály technik. Přítomnost buněčného cytoskeletu se potvrzuje barvením na vimentin, desmin, troponin, alfa-aktin a myosin hladkého svalstva, těžké řetězce alfa- a beta-myosinu, lehké řetězce-2 srdečního myosinu, alfa- a beta-tubulin. Buněčná kontraktilita se potvrzuje pozitivní odpovědí na epinefrin, angiotenzin II, bradykinin, karbachol, chlorid draselný, endotel I. Buněčné vztahy se určují interakcemi funkčních mezer a ověřují se mikroinjekcemi karboxyfluoresceinu. Matrixová sekrece se stanovuje barvením na prolyl-4-hydroxylázu / kolagen typu II, fibronektin, chondroitin sulfát, laminin. Inervace je stanovena blízkým umístěním motorických nervových zakončení, což se odráží v aktivitě neuropeptidu Y tyrosinhydroxylázy, acetylcholinesterázy, vazoaktivního intestinálního polypeptidu, substance P a peptidu souvisejícího s genem papriky. Mitogenní faktory jsou stanoveny pomocí krevního destičkového růstového faktoru, bazického fibroblastového růstového faktoru a serotoninu (5-HT). Studované intersticiální buněčné fibroblasty se vyznačují neúplnou bazální membránou, dlouhými, tenkými cytoplazmatickými výběžky, úzkým spojením s matricí, dobře vyvinutým nerovnoměrným endoplazmatickým retikulem a Golgiho aparátem, bohatstvím mikrofilament a tvorbou adhezivních vazeb.
Endokardiální buňky chlopní tvoří kolem každé srdeční chlopně funkční atrombogenní obal podobný cévnímu endotelu. Široce používaná metoda náhrady chlopně eliminuje ochrannou funkci endokardu, což může vést k ukládání krevních destiček a fibrinu na umělých chlopních, rozvoji bakteriální infekce a kalcifikaci tkání. Další pravděpodobnou funkcí těchto buněk je regulace podkladových intersticiálních buněk chlopní podobná regulaci buněk hladkého svalstva endotelem. Mezi endotelem a sousedními buňkami existují komplexní interakce, částečně zprostředkované rozpustnými faktory vylučovanými endotelovými buňkami. Tyto buňky tvoří na luminální straně obrovský povrch pokrytý mikrovýčnělky, čímž zvyšují expozici a možnou interakci s metabolickými látkami v cirkulující krvi.
Endotel často vykazuje morfologické a funkční rozdíly způsobené smykovým napětím na stěně cévy v důsledku průtoku krve, a to platí i pro endokardiální buňky chlopní, které zaujímají buď protáhlý, nebo polygonální tvar. Změny v buněčné struktuře mohou nastat v důsledku působení lokální hemodynamiky na složky buněčného cytoskeletu nebo sekundárních účinků způsobených změnami v podkladové extracelulární matrici. Na ultrastrukturální úrovni mají endokardiální buňky chlopní mezibuněčná spojení, plazmatické váčky, drsné endoplazmatické retikulum a Golgiho aparát. Ačkoli produkují von Willebrandův faktor in vivo i in vitro, chybí jim Weibel-Paladova tělíska (specifické granule obsahující von Willebrandův faktor), což jsou organely charakteristické pro cévní endotel. Endokardiální buňky chlopní se vyznačují silnými spojeními, interakcemi funkčních mezer a překrývajícími se marginálními záhyby.
Endokardiální buňky si zachovávají svou metabolickou aktivitu i in vitro: produkují von Willebrandův faktor, prostacyklin, syntázu oxidu dusnatého, vykazují aktivitu enzymu konvertujícího angiotenzin a intenzivně vylučují adhezní molekuly ICAM-1 a ELAM-1, které jsou důležité pro vazbu mononukleárních buněk během vývoje imunitní odpovědi. Všechny tyto markery by měly být zohledněny při pěstování ideální buněčné kultury pro vytvoření umělé chlopně pomocí tkáňového inženýrství, ale imunostimulační potenciál samotných chlopňových endokardiálních buněk může omezovat jejich použití.
Extracelulární matrix srdečních chlopní se skládá z vláknitých kolagenových a elastinových makromolekul, proteoglykanů a glykoproteinů. Kolagen tvoří 60 % suché hmotnosti chlopně, elastin 10 % a proteoglykany 20 %. Kolagenní složka zajišťuje hlavní mechanickou stabilitu chlopně a je reprezentována kolageny typu I (74 %), II (24 %) a V (2 %). Svazky kolagenních vláken jsou obklopeny elastinovým pouzdrem, které zprostředkovává interakce mezi nimi. Glykosaminoglykanové postranní řetězce molekul proteoglykanů mají tendenci tvořit gelovitou látku, ve které interagují další molekuly matrice za vzniku trvalých vazeb a ukládají se další složky. Glykosaminoglykany lidských srdečních chlopní se skládají převážně z kyseliny hyaluronové, v menší míře z dermatansulfátu, chondroitin-4-sulfátu a chondroitin-6-sulfátu, s minimálním množstvím heparansulfátu. Remodelace a obnova matrixové tkáně jsou regulovány matrixovými metaloproteinázami (MMP) a jejich tkáňovými inhibitory (TI). Tyto molekuly se také podílejí na širší škále fyziologických a patologických procesů. Některé metaloproteinázy, včetně intersticiálních kolagenáz (MMP-1, MMP-13) a želatináz (MMP-2, MMP-9) a jejich tkáňových inhibitorů (TI-1, TI-2, TI-3), se nacházejí ve všech srdečních chlopních. Nadměrná produkce metaloproteináz je charakteristická pro patologické stavy srdeční chlopně.
 [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Srdeční chlopně a jejich morfologická struktura
Srdeční chlopně se skládají ze tří morfologicky odlišných a funkčně významných vrstev cípové matrix: vláknité, houbovité a ventrikulární.
Vláknitá vrstva tvoří odolnou kostru chlopně proti zatížení, skládající se z vrstev kolagenních vláken. Tato vlákna jsou uspořádána radiálně v záhybech, aby umožnila arteriálním chlopním při zavírání roztažení. Vláknitá vrstva leží v blízkosti výstupního vnějšího povrchu těchto chlopní. Vláknitá vrstva atrioventrikulárních chlopní slouží jako pokračování kolagenních svazků šlach (chordae tendineae). Nachází se mezi houbovitou (vstupní) a ventrikulární (výstupní) vrstvou.
Mezi vláknitou a ventrikulární vrstvou se nachází houbovitá vrstva (spongiosa). Houbovitá vrstva se skládá ze špatně organizované pojivové tkáně ve viskózním prostředí. Dominantními složkami matrice této vrstvy jsou proteoglykany s náhodně orientovaným kolagenem a tenké vrstvy elastinu. Postranní řetězce molekul proteoglykanů nesou silný negativní náboj, který ovlivňuje jejich vysokou schopnost vázat vodu a tvořit porézní matriční gel. Houbovitá vrstva matrice snižuje mechanické namáhání v cípech srdeční chlopně a udržuje jejich flexibilitu.
Komorová vrstva je mnohem tenčí než ostatní a je bohatá na elastická vlákna, která umožňují tkáni odolávat neustálé deformaci. Elastin má houbovitou strukturu, která obklopuje a spojuje kolagenová vlákna a udržuje je v neutrálním složeném stavu. Vstupní vrstva chlopně (komorová - u arteriálních chlopní a houbovitá - u atrioventrikulární) obsahuje více elastinu než výstupní, což zajišťuje změkčení hydraulického rázu při uzavření cípů. Tento vztah mezi kolagenem a elastinem umožňuje cípům roztáhnout se až o 40 % bez stabilní deformace. Při vystavení malému zatížení se kolagenové struktury této vrstvy orientují ve směru zatížení a její odolnost vůči dalšímu růstu zátěže se zvyšuje.
Představa srdečních chlopní jako jednoduchých endokardiálních duplikátů je tedy nejen zjednodušená, ale také v podstatě nesprávná. Srdeční chlopně jsou složité orgány, které zahrnují vlákna pruhovaného svalstva, krevní a lymfatické cévy a nervové elementy. Jak svou strukturou, tak i svou funkcí jsou chlopně nedílnou součástí všech srdečních struktur. Analýza normální funkce chlopně musí brát v úvahu její buněčnou organizaci, stejně jako interakci buněk mezi sebou navzájem a s matricí. Poznatky získané z těchto studií jsou vedoucí v návrhu a vývoji chlopňových protetik s využitím tkáňového inženýrství.

