Systém podávání léků s uzavřenou smyčkou by mohl zlepšit chemoterapii
Naposledy posuzováno: 14.06.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Když pacienti s rakovinou podstupují chemoterapii, vypočítávají se dávky většiny léků na základě plochy povrchu těla pacienta. Tento indikátor se odhaduje pomocí rovnice, do které se dosadí výška a hmotnost pacienta. Tato rovnice byla formulována v roce 1916 na základě údajů od pouhých devíti pacientů.
Tento zjednodušený přístup k dávkování nebere v úvahu další faktory a může vést k tomu, že pacientovi bude předepsáno příliš mnoho nebo příliš málo léku. V důsledku toho mohou někteří pacienti pociťovat nadměrnou toxicitu nebo nedostatečnou účinnost jejich chemoterapie.
Pro zlepšení přesnosti dávkování chemoterapie vyvinuli inženýři MIT alternativní přístup, který umožňuje personalizaci dávky pro každého pacienta. Jejich systém měří množství léku v těle pacienta a tato data se zadávají do ovladače, který podle toho může upravit rychlost infuze.
Tento přístup může pomoci kompenzovat rozdíly ve farmakokinetice léků způsobené složením těla, genetickou predispozicí, toxicitou orgánů vyvolanou chemoterapií, interakcemi s jinými léky a potravinami a cirkadiánními fluktuacemi enzymů odpovědných za rozklad chemoterapeutických léků, říkají vědci. p>
„Věříme, že díky pokroku v pochopení toho, jak se léky metabolizují, a použití technických nástrojů pro zjednodušení personalizovaného dávkování můžeme pomoci změnit bezpečnost a účinnost mnoha léků,“ říká Giovanni Traverso, odborný asistent strojního inženýrství na MIT a gastroenterolog v nemocnici. Brigham and Women's Hospital a hlavní autor studie.
Louis DeRidder, postgraduální student MIT, je hlavním autorem článku publikovaného v Med.
Nepřetržité sledování
V této studii se vědci zaměřili na lék zvaný 5-fluorouracil, který se používá k léčbě kolorektálního karcinomu a další druhy rakoviny. Lék se obvykle podává po dobu 46 hodin a dávkování se určuje pomocí vzorce založeného na výšce a hmotnosti pacienta, který poskytuje odhad plochy povrchu těla.
Tento přístup však nezohledňuje rozdíly ve složení těla, které mohou ovlivnit distribuci léku v těle, ani genetické variace, které ovlivňují jeho metabolismus. Tyto rozdíly mohou vést ke škodlivým vedlejším účinkům, pokud je léku příliš mnoho. Pokud lék nestačí, nemusí nádor zabít, jak se očekávalo.
"Lidé se stejným tělesným povrchem mohou mít velmi rozdílnou výšku a váhu, rozdílnou svalovou hmotu nebo genetiku, ale pokud výška a hmotnost vložená do této rovnice dává stejnou plochu tělesného povrchu, jejich dávka je identická," říká DeRidder, kandidát PhD v programu lékařského inženýrství a lékařské fyziky na Harvard-MIT Health Sciences and Technology Program.
Dalším faktorem, který může kdykoli změnit množství léku v krvi, je cirkadiánní fluktuace enzymu zvaného dihydropyrimidindehydrogenáza (DPD), který štěpí 5-fluorouracil. Exprese DPD, stejně jako mnoho jiných enzymů v těle, je regulována cirkadiánním rytmem. Degradace 5-FU DPD tedy není konstantní, ale mění se v závislosti na denní době. Tyto cirkadiánní rytmy mohou mít za následek desetinásobné kolísání množství 5-fluorouracilu v krvi pacienta v průběhu infuze.
"Pomocí plochy povrchu těla k výpočtu dávky chemoterapie víme, že dva lidé mohou mít zcela odlišnou toxicitu než 5-fluorouracil. Jeden pacient může mít léčebné cykly s minimální toxicitou a poté cyklus s hroznou toxicitou. Něco se změnilo v tom, jak to pacient metabolizoval chemoterapii z jednoho cyklu na druhý. Naše zastaralá metoda dávkování tyto změny nezachytí a pacienti v důsledku toho trpí,“ říká Douglas Rubinson, klinický onkolog z Dana-Farber Cancer Institute a autor článku.
Jedním ze způsobů, jak se pokusit kompenzovat variabilitu farmakokinetiky chemoterapie, je strategie zvaná terapeutické monitorování léků, při kterém pacient poskytne vzorek krve na konci jednoho léčebného cyklu. Poté, co je tento vzorek analyzován na koncentrace léčiva, lze dávku v případě potřeby upravit na začátku dalšího cyklu (u 5-fluorouracilu obvykle po dvou týdnech).
Ukázalo se, že tento přístup vede k lepším výsledkům u pacientů, ale nebyl široce používán pro chemoterapie, jako je 5-fluorouracil.
Výzkumníci z MIT chtěli vyvinout podobný typ monitorování, ale automatizovaným způsobem, který by mohl přizpůsobit dávkování léků v reálném čase, což by mohlo vést k lepším výsledkům pro pacienty.
V jejich systému s uzavřenou smyčkou lze kontinuálně monitorovat koncentrace léčiva a tyto informace se používají k automatickému nastavení rychlosti infuze chemoterapeutického léčiva tak, aby se dávka udržela v cílovém rozmezí.
Tento systém s uzavřenou smyčkou umožňuje personalizaci dávkování léků tak, aby byly zohledněny cirkadiánní rytmy měnících se hladin enzymů metabolizujících léky a také jakékoli změny ve farmakokinetice pacienta od poslední léčby, jako je orgánová toxicita vyvolaná chemoterapií.
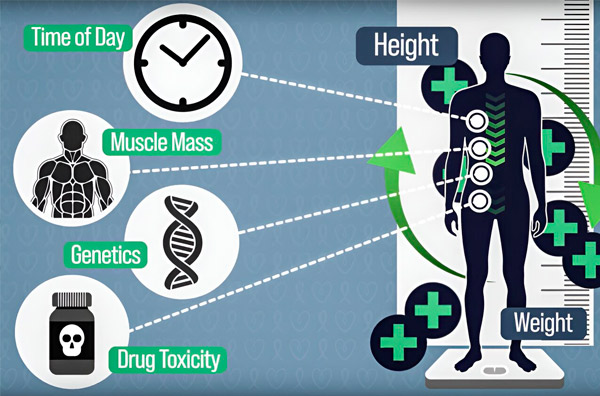
Pro zpřesnění dávkování chemoterapie vyvinuli inženýři MIT způsob, jak nepřetržitě měřit množství léku v těle pacienta během hodinové infuze. To pomůže kompenzovat rozdíly způsobené složením těla, genetikou, toxicitou léků a cirkadiánními výkyvy. Zdroj: Poskytli výzkumníci.
Nový systém vyvinutý výzkumníky, známý jako CLAUDIA (AUtomated Drug Infusion RegulAtor s uzavřenou smyčkou), využívá pro každý krok komerčně dostupné vybavení. Vzorky krve se odebírají každých pět minut a rychle se připraví k analýze. Měří se koncentrace 5-fluorouracilu v krvi a porovnává se s cílovým rozmezím.
Rozdíl mezi cílovou a naměřenou koncentrací je zadán do kontrolního algoritmu, který pak v případě potřeby upraví rychlost infuze, aby se dávka udržela v rozmezí koncentrací, při kterém je lék účinný a netoxický.
"Vyvinuli jsme systém, ve kterém můžeme nepřetržitě měřit koncentrace léčiva a podle toho upravovat rychlost infuze, abychom udrželi koncentrace léčiva v terapeutickém okně," říká DeRidder.
Rychlé nastavení
V testech na zvířatech vědci zjistili, že pomocí CLAUDIA byli schopni udržet množství drogy cirkulující v těle v cílovém rozmezí asi 45 procent času.
Hladiny léčiva u zvířat léčených chemoterapií bez přípravku CLAUDIA zůstaly v cílovém rozmezí v průměru pouze 13 procent času. V této studii výzkumníci netestovali účinnost hladin léčiva, ale předpokládá se, že udržení koncentrací v rámci cílového okna povede k lepším výsledkům a menší toxicitě.
CLAUDIA byla také schopna udržet dávku 5-fluorouracilu v cílovém rozmezí i při podávání léku, který inhibuje enzym DPD. U zvířat léčených tímto inhibitorem bez neustálého sledování a úpravy se hladiny 5-fluorouracilu zvýšily až osminásobně.
Pro tuto ukázku výzkumníci ručně provedli každý krok procesu pomocí standardního vybavení, ale nyní plánují každý krok zautomatizovat, aby monitorování a úpravy dávky bylo možné provádět bez lidského zásahu.
K měření koncentrací léčiva použili vědci vysokoúčinnou kapalinovou chromatografii-hmotnostní spektrometrii (HPLC-MS), což je technika, kterou lze upravit k detekci prakticky jakéhokoli typu léčiva.
„Představujeme si budoucnost, ve které budeme moci použít CLAUDIA pro jakýkoli lék, který má vhodné farmakokinetické vlastnosti a je detekovatelný pomocí HPLC-MS, což umožňuje personalizované dávkování pro mnoho různých léků,“ říká DeRidder.
