Vědci sledují nejranější fyzické změny v buňkách, které způsobují rakovinu
Naposledy posuzováno: 14.06.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Když je diagnostikována rakovina, je za tím již mnoho událostí na buněčné a molekulární úrovni, které se odehrály bez povšimnutí. Ačkoli je rakovina pro klinické účely klasifikována do časných a pozdních stádií, dokonce i nádor v „časném“ stádiu je výsledkem mnoha předchozích změn v těle, které byly nedetekovatelné.
Nyní vědci z Yale University School of Medicine (YSM) a jejich kolegové podrobně porozuměli některým z těchto raných změn pomocí výkonné mikroskopie s vysokým rozlišením ke sledování úplně prvních fyzických změn, které způsobují rakovinu v buňkách myší kůže..
Studiem myší, které nesou mutaci, která podporuje rozvoj rakoviny ve vlasových folikulech, vědci zjistili, že první známky vzniku rakoviny se objevují v určitém čase a na určitém místě v růstu vlasových folikulů myší. A co víc, zjistili, že tyto prekancerózní změny lze blokovat léky známými jako inhibitory MEK.
Tým vedl Tianchi Xin, Ph.D., postdoktorand na katedře genetiky YSM, a zahrnoval Valentinu Greco, Ph.D., profesorku genetiky YSM a člen Yale Cancer Center and Yale Stem Cell Center a Sergi Regot, Ph.D., odborný asistent molekulární biologie a genetiky na Johns Hopkins School of Medicine.
Výsledky jejich výzkumu byly publikovány v časopisu Nature Cell Biology.
Vědci studovali myši, u kterých se vyvinul kožní spinocelulární karcinom, druhý nejčastější typ rakoviny kůže u lidí. Tyto myši byly geneticky upraveny tak, aby měly rakovinu podporující mutaci v genu KRAS, který je jedním z nejčastěji mutovaných onkogenů u lidských rakovin. Mutace KRAS byly také nalezeny u rakoviny plic, slinivky břišní a kolorektálního karcinomu.
První změny, které vědci studovali, zahrnovaly růst malého abnormálního hrbolku ve vlasovém folikulu, který je klasifikován jako prekancerózní abnormalita. "Porozumění těmto časným událostem nám může pomoci vyvinout přístupy k prevenci vzniku rakoviny," řekl Xin, první autor studie.
Přestože se jejich studie zaměřila na rakovinu kůže, vědci se domnívají, že principy, které objevili, by mohly být aplikovány na mnoho dalších rakovin způsobených mutacemi KRAS, protože klíčové geny a proteiny, kterých se to týká, jsou u různých nádorů stejné.
Víc než jen množení buněk U lidí i myší vlasové folikuly neustále rostou, padají staré vlasy a tvoří se nové. Velkou roli v tomto procesu obnovy hrají kmenové buňky, které mají schopnost vyvinout se do různých typů buněk. Předchozí studie ukázaly, že mutace KRAS vedou ke zvýšené proliferaci kmenových buněk ve vlasových folikulech a tento významný nárůst počtu kmenových buněk byl považován za odpovědný za prekancerózní tkáňové léze.
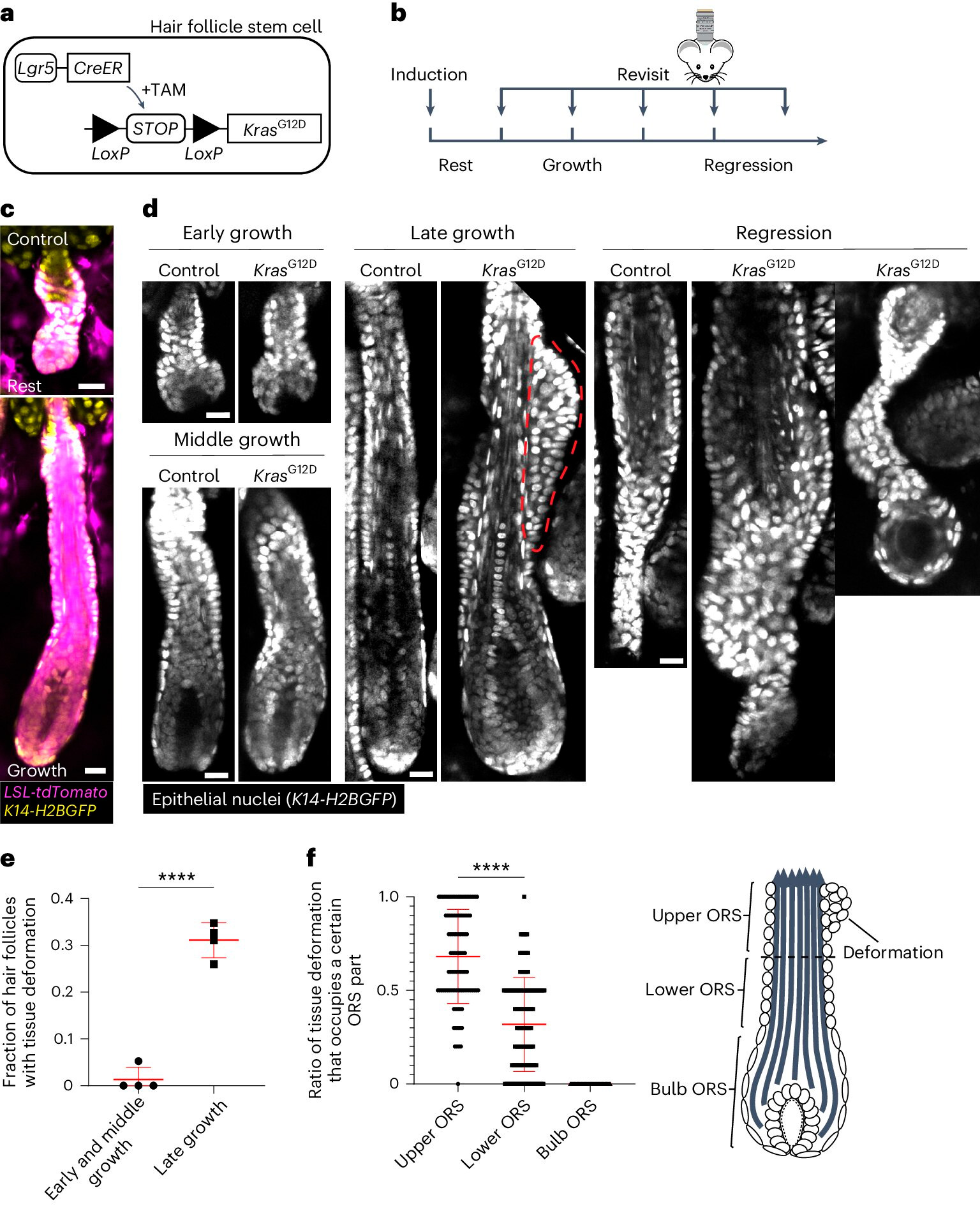
KrasG12D způsobuje časoprostorové specifické deformace tkáně během regenerace vlasových folikulů.
A. Schéma genetického přístupu k indukci KrasG12D v kmenových buňkách vlasových folikulů pomocí tamoxifenem indukovatelného Cre–LoxP (TAM) systému.
b. Diagram ukazující načasování indukce a opětovného zobrazení KrasG12D ve vztahu k fázím cyklu růstu vlasů.
C. Reprezentativní snímky divokého typu odpočívajících a rostoucích vlasových folikulů obsahujících Cre tdTomato (Magenta) indukovatelný reportér po indukci.
d. Reprezentativní snímky kontrolních a vlasových folikulů KrasG12D v různých fázích cyklu růstu vlasů. Deformace tkáně ve formě tuberkul ve vnější kořenové pochvě (ORS) je označena červenou tečkovanou čarou.
E. Podíl vlasových folikulů KrasG12D s deformací tkáně v různých fázích růstu vlasových folikulů.
F. Podíl tkáňových deformací, které zaujímají horní, dolní a baňatou část ORS pro jednotlivé vlasové folikuly KrasG12D.
Zdroj: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
K otestování této hypotézy tým použil speciálně navrženou formu mutovaného KRAS, který by mohl aktivovat v určitých časech v kožních buňkách vlasových folikulů zvířat. Xin a jeho kolegové použili mikroskopickou techniku známou jako intravitální zobrazování, která umožňuje snímky buněk v živém těle s vysokým rozlišením a taguje a sleduje jednotlivé kmenové buňky u zvířat.
Když byla aktivována mutace KRAS, všechny kmenové buňky se začaly množit rychleji, ale prekancerózní hrbol se vytvořil pouze na jednom konkrétním místě ve vlasovém folikulu a v jedné fázi růstu, což znamená, že celkový nárůst počtu buněk pravděpodobně nebyl ne celý příběh.
Aktivace mutace KRAS ve vlasových folikulech vedla k rychlejší proliferaci kmenových buněk, změně jejich migračních vzorů a dělení v různých směrech ve srovnání s buňkami bez mutace podporující rakovinu.
Mutace ovlivňuje protein známý jako ERK. Xin dokázal v reálném čase pozorovat aktivitu ERK v jednotlivých kmenových buňkách u živých zvířat a objevil specifickou změnu aktivity tohoto proteinu způsobenou mutací KRAS. Vědcům se také podařilo zastavit tvorbu prekancerózního hrbolu pomocí inhibitoru MEK, který blokuje aktivitu ERK.
Lék zastavil účinky mutace na migraci a orientaci buněk, ale ne na celkovou proliferaci kmenových buněk, což znamená, že vznik prekancerózního stavu je způsoben těmito prvními dvěma změnami a nikoli zvýšenou proliferací buněk.
Prekancerózní změny v kontextu Sledování účinků onkogenní mutace v reálném čase v živém organismu je jediný způsob, jak byli vědci schopni tyto principy objevit. To je důležité, protože rakovina nevzniká ve vakuu – její růst a udržování je velmi závislé na jejím mikroprostředí. Vědci také potřebovali sledovat nejen chování jednotlivých buněk, ale také molekul v těchto buňkách.
"Přístup, který jsme zvolili k pochopení těchto onkogenních událostí, je ve skutečnosti o propojení napříč měřítky," řekl Greco. „Koncepce a přístupy, které Dr. Xin použil ve spolupráci s Dr. Regotem, nám umožnily přejít dolů k molekulárním prvkům a propojit je s buněčným a tkáňovým měřítkem, což nám dává řešení těchto událostí, které je tak obtížné dosáhnout mimo živý organismus."
Vědci nyní chtějí sledovat proces po delší časové období, aby viděli, co se stane poté, co se vytvoří počáteční náraz. Chtějí také studovat další onkogenní události, jako je zánět, aby zjistili, zda principy, které objevili, platí i v jiných kontextech.
