Identifikován protein zodpovědný za genetické zánětlivé onemocnění
Naposledy posuzováno: 14.06.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Tým výzkumníků vedený Dr. Hirotsugu Odou z CECAD Cluster of Excellence for Aging Research na univerzitě v Kolíně nad Rýnem objevil roli, kterou hraje specifický proteinový komplex v některých formách imunitní dysregulace. Tento výsledek může vést k vývoji nových terapeutických přístupů zaměřených na snížení autoinflace a „obnovu“ imunitního systému pacientů trpících genetickou dysfunkcí tohoto proteinového komplexu.
Studie „Biallelic human SHARPIN loss of function indukuje autoinflammation and immunodeficiency“ byla publikována v Nature Immunology.
Lineární ubiquitin-assembling complex (LUBAC), složený z proteinů HOIP, HOIL-1 a SHARPIN, je již dlouho uznáván pro svou zásadní roli při udržování imunitní homeostázy. Předchozí studie na myších ukázaly vážné důsledky ztráty SHARPIN, což vedlo k těžké dermatitidě v důsledku nadměrné smrti kožních buněk. Konkrétní důsledky nedostatku SHARPIN na lidské zdraví však dosud zůstaly nejasné.
Výzkumný tým poprvé hlásí dva lidi s nedostatkem SHARPIN, kteří vykazují příznaky autoinflace a imunodeficience, ale neočekávaně nevykazují dermatologické problémy, jak je vidět u myší.
Po dalším zkoumání bylo zjištěno, že tito jedinci mají narušenou kanonickou NF-κB odpověď, dráhu důležitou pro imunitní odpověď. Měli také zvýšenou citlivost na buněčnou smrt způsobenou členy superrodiny tumor nekrotizujícího faktoru (TNF). Léčba jednoho z pacientů s deficitem SHARPIN anti-TNF terapií, která specificky inhibuje TNF-indukovanou buněčnou smrt, vedla k úplnému vyřešení autoinflace na buněčné úrovni a v klinické prezentaci.
Výzkum ukazuje, že nadměrná a nekontrolovaná buněčná smrt hraje zásadní roli u lidských genetických zánětlivých onemocnění. Odův tým přidal nedostatek SHARPIN jako nového člena skupiny genetických lidských zánětlivých onemocnění, které navrhují nazývat "vrozené chyby buněčné smrti."
Ochrana před imunitní dysregulací Studie byla zahájena v laboratoři Dr. Dana Kastnera v National Institutes of Health (NIH) ve Spojených státech. Tamní vědci byli schopni pozorovat jednoho pacienta s nevysvětlitelnými epizodami horečky, artritidy, kolitidy a imunodeficience v dětství.
Po získání informovaného souhlasu provedli sekvenování exomu u pacienta a jeho rodiny a zjistili, že pacient měl rušivou genetickou variantu v genu SHARPIN, která vedla k nedetekovatelným hladinám proteinu SHARPIN. Zjistili také, že buňky pacientů vykazovaly zvýšený sklon k smrti jak v kultivovaných buňkách, tak v biopsiích pacientů.
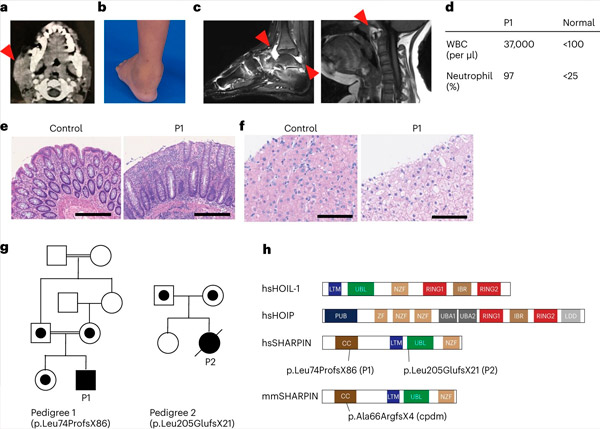
Nedostatek SHARPINu u lidí způsobuje autoinflamaci a jaterní glykogenózu. Zdroj: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Tým také zjistil, že vývoj lymfoidních zárodečných center - specializovaných mikrostruktur v adenoidech, které jsou kritické pro dozrávání B buněk našeho imunitního systému, a tedy produkci protilátek - byl významně snížen kvůli zvýšené smrti B buněk. Tyto výsledky vysvětlují imunodeficienci u pacientů a zdůrazňují důležitou roli LUBAC při udržování imunitní homeostázy u lidí.
„Naše studie zdůrazňuje zásadní význam LUBAC při ochraně před imunitní dysregulací. Objasněním molekulárních mechanismů, které jsou základem nedostatku LUBAC, připravujeme cestu pro nové terapeutické strategie zaměřené na obnovení imunitní homeostázy,“ řekl Oda, hlavní autor studie.
Dodal: „Jeden z pacientů s nedostatkem přípravku SHARPIN byl mnoho let závislý na invalidním vozíku, než jsme ho poprvé viděli. Bolely ho kotníky a chodit bylo příliš bolestivé. Genetická diagnóza nám umožnila zaměřit se na správnou molekulární dráhu, která je základem jeho onemocnění.“
Od té doby, co pacient začal dostávat anti-TNF terapii, je téměř sedm let bez příznaků. „Jako klinický lékař a vědec jsem rád, že mám příležitost pozitivně ovlivnit život jednoho pacienta prostřednictvím našeho výzkumu,“ uzavřel Oda.
