Deriváty thalidomidu vedou ke smrti rezistentních rakovinných buněk
Naposledy posuzováno: 14.06.2024

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Studie provedená Goethe-University Frankfurt poukazuje na možnost, že deriváty thalidomidu jsou potenciálně vhodné pro léčbu rakoviny. V padesátých letech se thalidomid prodával jako prášek na spaní. Později se stala notoricky známou tím, že způsobovala vážné malformace u plodu v raných fázích těhotenství.
Je také známo, že molekula označuje proteiny v buňce za účelem jejich zničení. V rámci současného výzkumu vědci vytvořili deriváty thalidomidu. Podařilo se jim prokázat, že tyto látky ovlivňují destrukci proteinů odpovědných za přežití rakovinných buněk.
Snad žádná jiná molekula nemá tak bouřlivou minulost jako thalidomid. Byl hlavní složkou léku schváleného v mnoha zemích v 50. Letech minulého století jako sedativum-hypnotikum. Brzy se však ukázalo, že těhotné ženy užívající thalidomid často rodily děti s vážnými deformacemi.
V posledních desetiletích do něj však medicína opět vkládá velké naděje. Výzkumy mimo jiné prokázaly, že inhibuje růst krevních cév, a proto je potenciálně vhodný k odříznutí nádorů od jejich živného média. Pak se také ukázal jako velmi účinný při léčbě mnohočetného myelomu, zhoubných nádorů v kostní dřeni.
„Nyní víme, že thalidomid lze nazvat „molekulárním lepidlem“,“ vysvětluje Dr. Xinglai Cheng z Institutu farmaceutické chemie na Goethe-University Frankfurt. "To znamená, že je schopen uchopit dva proteiny a spojit je."
To je obzvláště zajímavé, protože jeden z těchto proteinů je jakýmsi „strojem na označování“: připojuje k jinému proteinu jednoznačné označení „TRASH“.
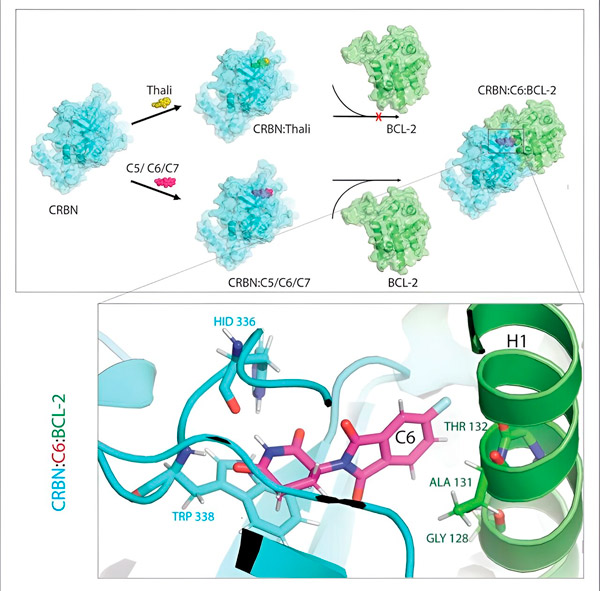
Thalidomidové deriváty C5, C6 a C7 modifikují CRBN, "stroj na označování", aby se mohl vázat na BCL-2. Molekula BCL-2 je tedy označena pro degradaci – možnou novou strategii v boji proti rakovině. Autor: Dr. Xinglai Cheng
Systém likvidace odpadu buňky rozpozná tuto značku: uchopí označenou molekulu proteinu a rozdrtí ji. "Je to tento mechanismus, který vysvětluje různé účinky thalidomidu," říká Cheng. "V závislosti na tom, který protein je označen, to může vést k deformacím během embryonálního vývoje nebo ke zničení maligních buněk."
Tento mechanismus nabízí velký lékařský příslib, protože přežití rakovinných buněk závisí na určitých proteinech. Pokud by se na ně dalo systematicky zaměřit a skartovat, mohla by být nemoc vyléčena. Problém je v tom, že molekulární lepidlo je docela zvláštní.
Jedním z jejích vazebných partnerů je vždy stroj na značení buněk nebo ve vědeckém jazyce E3 ligáza nazývaná CRBN. Jen velmi málo z mnoha tisíců bílkovin v těle může být druhým partnerem – které závisí na lepidle.
"Takže jsme vytvořili řadu derivátů thalidomidu," říká Cheng. "Pak jsme zkoumali, zda mají adhezivní vlastnosti, a pokud ano, proti jakým proteinům byly účinné." K tomu vědci přidali své deriváty ke všem proteinům v pěstované buněčné linii. Poté pozorovali, které z těchto proteinů se pak degradovaly v přítomnosti CRBN.
"V tomto procesu jsme identifikovali tři deriváty, které by mohly označit buněčný protein, který je velmi důležitý pro degradaci, BCL-2," vysvětluje Cheng. "BCL-2 brání buňkám aktivovat program sebezničení, takže pokud chybí, buňky umírají."
BCL-2 je proto dlouho středem zájmu výzkumu rakoviny. Dokonce již existuje lék na leukémii zvaný venetoklax, který snižuje účinnost BCL-2 a způsobuje tak samodestrukci mutovaných buněk.
"V mnoha rakovinných buňkách je však mutován samotný BCL-2. Výsledkem je, že venetoklax již neinhibuje protein," říká Cheng. "Podařilo se nám prokázat, že naše deriváty označují i tuto mutovanou formu pro degradaci. Navíc naši partneři z Institutu Maxe Plancka pro biofyziku simulovali interakci derivátů thalidomidu s BCL-2 na počítači. To ukázalo, že se deriváty vážou na úplně jiná místa než venetoklax – výsledek, který jsme později také mohli experimentálně potvrdit.“
Vědci navíc testovali své látky na octomilkách s rakovinnými buňkami. Míra přežití mušek ošetřených tímto způsobem byla výrazně vyšší. Cheng však varuje před přílišným vzrušením, protože tyto výsledky jsou stále základním výzkumem. "Přestože ukazují, že modifikované molekuly thalidomidu mají velký terapeutický potenciál, nemůžeme zatím říci, zda se v nějakém okamžiku osvědčí v praxi."
Výsledky studie byly publikovány v žurnálu Cell Reports Physical Science.
