Nové publikace
Studie zdůrazňuje potřebu specifické buněčné terapie HIV.
Naposledy posuzováno: 02.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Výzkumníci z University of Illinois prokázali důležitost cílení na specifické typy buněk při léčbě HIV. Jejich studie, publikovaná v časopise Proceedings of the National Academy of Sciences, je jednou z prvních, která se zabývá diferenciálními nebo typově specifickými účinky modulace latence HIV na myeloidní buňky, což je typ imunitních buněk produkovaných v kostní dřeni.
Jednou z hlavních překážek eliminace HIV infekce je zvládání latence, neboli doby, během níž infikovaná buňka dormantně ležela a nemohla produkovat virus. Latentní HIV buňky se v těle hromadí v místech známých jako rezervoáry. Latentní rezervoáry jsou problematické, protože mohou začít produkovat virus kdykoli.
Úplná eradikace onemocnění by vyžadovala odstranění všech latentních buněk z těla nebo trvalou rezistenci vůči aktivačním podnětům. Reaktivaci však může spustit řada faktorů, včetně signálů, které řídí diferenciaci myeloidních buněk.
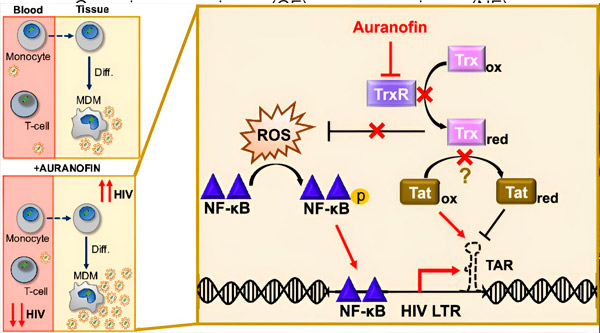
Regulace latence HIV v makrofágech odvozených z monocytů (MDM) může představovat riziko pro šíření viru. Diferenciace monocytů na makrofágy může spustit reaktivaci HIV, což potenciálně podporuje šíření viru v tkáních (vlevo nahoře). Klinický kandidát, Auranofin, snižuje virovou DNA v krvi a podporuje latenci HIV v T buňkách a monocytech, ale způsobuje reaktivaci HIV v MDM (vlevo dole). U MDM předpokládáme, že inhibice TrxR pomocí Auranofinu vede k akumulaci reaktivních forem kyslíku (ROS), což indukuje aktivaci NF-κB a aktivaci promotoru HIV LTR (vpravo). Inhibice TrxR potenciálně snižuje redukci substrátu, což umožňuje proteinu Tat zůstat přednostně oxidovaný, kde se může vázat na TAR a iniciovat transkripci HIV. Zdroj: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Výzkum léčby HIV se po léta soustředil na dva přístupy známé jako „šok a zabití“ a „blokování a uzamčení“. První z nich funguje v kombinaci s antiretrovirovou terapií k aktivaci latentně infikovaných buněk a jejich zabití apoptózou neboli programovanou buněčnou smrtí, zatímco druhý nutí infikované buňky do hlubokého latentního stavu, ze kterého se nemohou samy reaktivovat.
Výzkum těchto technik se tradičně zaměřoval na typ bílých krvinek zvaných T buňky, které jsou primárním cílem infekce HIV. Latentní rezervoáry však tvoří více než jen T buňky; ve skutečnosti obsahují desítky různých typů buněk, z nichž každý má své vlastní jedinečné vzorce genové exprese HIV.
„Existuje obrovská rozmanitost buněk, a to i v rámci jedné linie,“ řekl Collin Kieffer, odborný asistent mikrobiologie a autor článku. „Variabilita odpovědi v těchto rezervoárech se zvyšuje s každým novým typem buňky.“
Alexandra Blanco, postgraduální studentka v Kiefferově laboratoři, chtěla studovat buněčné typy, které byly v tradičním výzkumu HIV opomíjeny. Zaměřila se na myeloidní buňky a vytvořila knihovnu klonů obsahující 70 populací latentně infikovaných monocytů. Blanco poté analyzovala klonální populace a jejich reakce na aktivaci. Reakce se značně lišily, což zdůraznilo velkou rozmanitost v rámci jednoho buněčného typu.
Toto pozorování vyvolalo novou otázku: skutečně různé typy buněk reagují na léčbu latence HIV odlišně? Jejich zjištění skutečně ukázala, že některé terapie latence HIV mohou latenci v T buňkách a monocytech podpořit, zatímco v makrofágech mohou latenci zvrátit.
„Ne všechny buňky v těle jsou stejné,“ řekl Kieffer. „Dává tedy smysl, že ne všechny infikované buňky budou na virus reagovat stejným způsobem.“
Jejich článek zdůrazňuje potřebu, aby budoucí léčba HIV zohledňovala všechny typy buněk a to, jak by každá buňka mohla reagovat na potenciální terapie.
Jejich zjištění vycházejí z výzkumu Roye Dara, bývalého profesora bioinženýrství z Illinois, jehož laboratoř studovala heterogenitu v genové expresi HIV.
„On to začal a my jsme to převzali a dovedli to tam, kde je to dnes,“ řekl Kieffer. „Takže tato spolupráce skutečně nastartovala tyto výsledky. Pro naši laboratoř se z toho stal nový směr a my jsme z toho opravdu nadšení.“
Další a neočekávaný nález z Blancovy analýzy odhalil změny ve velikosti a tvaru buněk v reakci na infekci, což naznačuje, že HIV může změnit morfologii buněk. Blancova dalšího cíle je identifikovat biologické mechanismy, které jsou základem těchto fenotypových změn.
Kieffer a členové jeho laboratoře se také těší na reprodukci svých výsledků, které byly většinou získány na buněčné linii, v primárních buňkách. Reprodukce výsledků v modelu bližším lidskému by zlepšila klinický význam studie, vysvětlil Kieffer.
„Rádi bychom provedli rozsáhlejší screening T buněk, monocytů a makrofágů, abychom identifikovali potenciální léky, které by mohly působit na všechny tyto typy buněk,“ řekl Blanco. „Mohli bychom najít ještě více molekul, které se nechovají specifickým způsobem pro daný typ buňky.“
