Nové publikace
„Kyslík pro buňky“: jednoduchý implantát pomohl snížit hladinu cukru bez silných léků
Naposledy posuzováno: 18.08.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
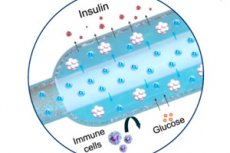
V časopise Nature Communications byl popsán nový „kyslíkový“ implantát pro léčbu diabetu 1. typu: kompaktní elektrochemický generátor kyslíku (iEOG) nepřetržitě dodává O₂ do makrokapsule s buňkami vylučujícími inzulín. Tento systém umožňuje těsné uspořádání izolovaných ostrůvků (až 60 000 IEQ/ml) a udržuje jejich životaschopnost a sekreci i za podmínek nízkého obsahu kyslíku. U krys s diabetem udržovalo zařízení implantované pod kůži normální hladinu cukru až tři měsíce – bez imunosuprese. Kontrolní krysy bez kyslíku zůstaly hyperglykemické.
Pozadí
- Hlavním technickým problémem je kyslík. Jakmile buňky „schováme“ za membránu a zařízení umístíme pod kůži (pohodlně a snadno extrahujeme), dochází jim k nedostatku kyslíku: difúze přes membránu a špatně prokrvené místo neuspokojuje potřeby „nažravých“ ostrůvků. Proto dochází k předčasnému odumírání, slabé práci a nutnosti výrazně ztenčit výsev – jinak se kapsle ukáže jako obrovská.
- Proč je to fyzicky tak obtížné? Kyslík prochází tkáněmi pouze na velmi krátké vzdálenosti a zapouzdřené buňky nemají vlastní cévy – první měsíce žijí pouze díky pasivní difúzi. Jakékoli ztluštění materiálů nebo „zhutnění“ buněk rychle přenáší střed pouzdra do hypoxie.
- Co jsi už zkoušel/a?
- Vyrobili makrozařízení s možností doplnění kyslíkem (například βAir): uvnitř je zásobník, který se denně doplňuje kyslíkem; proběhly preklinické a rané klinické studie. Funguje to, ale pro pacienta je to pracné.
- Byly vyzkoušeny chemické donory O₂ a „nosiče“ (perfluorované sloučeniny): pomáhají, ale mají krátkodobý a obtížně kontrolovatelný účinek. Objevily se také „vzduchové“ rámy pro urychlení dodávání O₂ do tloušťky gelu.
- Samotné kapsle a místa implantace (tenké membrány, prevaskularizace) byly vylepšeny, ale bez externího zdroje O₂ stále narážejí na limity buněčné hustoty.
- Jakou mezeru v skládačce nová práce vyplňuje? Autoři Nature Communications ukazují nepřetržitý přísun kyslíku z minigenerátoru přímo uvnitř makroenkapsulačního systému: zařízení odebírá vodu z tkání a elektrochemicky uvolňuje O₂, který rovnoměrně „dýchá“ podél kapsle s buňkami. Cílem je dát kapsli „vlastní akvarijní kompresor“, aby mohla sbalit více buněk a přitom je udržet naživu a funkční – a to i v podkožním, ne příliš „okysličeném“ místě.
Proč je to vůbec nutné?
Transplantace ostrůvků nebo beta buněk je jednou z nejslibnějších cest k „funkčnímu vyléčení“ diabetu 1. typu. Existují však dvě hlavní překážky:
- Imunita - obvykle vyžaduje celoživotní užívání imunosupresiv;
- Kyslíkové hladovění – kapsle, které chrání imunitní systém, současně oddělují buňky od cév a beta buňky, nenasytné po O₂, se rychle „udusí“. Nová práce naráží na druhou bariéru: poskytuje kapsli vlastní, kontrolovaný zdroj kyslíku.
Jak implantát funguje
- Dvě části. V titanovém pouzdře je mini-generátor kyslíku (iEOG), který extrahuje vodu z intersticiální tekutiny a elektrolýzou uvolňuje O₂; vedle něj je tenká lineární kapsle s buňkami (podobná dlouhé „klobáse“), kterou prochází plynopropustná trubice: kyslík je rovnoměrně absorbován podél celé kapsle. Mezi buňkami a tkáněmi je polopropustná membrána (elektrospin + alginát): glukóza a inzulin procházejí, imunitní buňky ne.
- Rozměry: Druhá verze iEOG má průměr 13 mm a tloušťku 3,1 mm, váží přibližně 2 g. V kombinaci s kapslí lze takový systém zavádět a vyjímat malým řezem, což je důležité z bezpečnostních důvodů.
- Produktivita. Generátor produkuje ~1,9–2,3 cm³ O₂/h a udržuje stanovený průtok po dobu měsíců a dokonce i let (při dlouhodobých testech ve fyziologickém roztoku – až 2,5 roku) a po implantaci u potkanů byla tato úroveň udržena. Takový průtok je vypočítán tak, aby pokryl potřeby stovek tisíc ekvivalentů ostrůvků – řádově tolik, kolik člověk potřebuje.
Co ukázaly experimenty
- In vitro: Při 1 % O₂ (těžká hypoxie) oxygenace udržovala životaschopnost a sekreci v agregátech INS-1 a v lidských ostrůvcích uspořádaných ve velmi husté vrstvě (60 000 IEQ/ml).
- In vivo (krysy). Po subkutánní implantaci v alogenním modelu diabetu normalizoval systém iEOG glykémii až na 3 měsíce bez imunosuprese; zařízení bez kyslíku neměla žádný účinek. Histologie kolem generátoru neprokázala žádné významné nežádoucí účinky.
Proč je to pro kliniku důležité?
- Krok k „realistickým rozměrům“. Aby dospělý dostal dávku 300–770 tisíc IEQ, musí být kapsle pevně zabalená – to bylo vždy omezeno kyslíkem. Řízený přívod O₂ „odstraňuje strop“ hustoty a dává šanci vytvořit zařízení dostatečně kompaktní pro skutečnou implantaci.
- Plus pohodlí. Dříve jsme vyzkoušeli chemické donory kyslíku (peroxidy) - ty nefungují dlouho a jsou nekontrolovatelné, stejně jako zásobníky O₂ s každodenním „doplňováním“ přes kůži - těžkopádné a nepohodlné. Zde je kyslík dodáván neustále a v odměřených dávkách, bez injekcí.
Technické detaily, které ohromí
- Zdrojem vody je tkáň. iEOG nasává páru intersticiální tekutiny porézním „oknem“ a poté se pomocí klasické membránově-elektrodové sestavy (MEA) a napětí 1,4–1,8 V voda oddělí na H₂ a O₂; plyny se odvádějí různými kanály.
- Trvanlivost. Tři zařízení ve fyziologickém roztoku fungovala 11 měsíců, 2 roky a 2,5 roku na stejnosměrný proud bez degradace proudem kyslíku; po implantaci imunodeficientním a imunokompetentním krysám byl výkon zachován.
Omezení a „co dál“
Tohle je stále v předklinické fázi: krysy, vysoká hustota v kapsli, přívod kyslíku - všechno je skvělé, ale klíčové testy teprve čekají:
- škálování na lidské dávky a časové rámce;
- spolehlivost a napájení elektrochemiků v lidském těle po celá léta (architektura napájení není v článku podrobně popsána);
- minimalizace fibrózy kolem kapslí a difuzní stabilita;
- testování na beta kmenových buňkách a na modelech bližších lidským. Autoři otevřeně porovnávají své řešení s předchozími přístupy a prezentují ho jako platformu pro klinicky přenositelné kapsle.
Závěr
Aby transplantované beta buňky mohly žít a fungovat bez imunosupresiv, potřebují dýchat. Tým Cornella a partnerů ukázal, že mini generátor kyslíku zabudovaný do lineární kapsle dokáže „krmit“ buňky O₂ dostatečně dlouho a rovnoměrně, aby odolaly vysoké hustotě a snížily hladinu cukru i v podkoží. Klinické výsledky jsou stále ještě daleko, ale inženýrská logika je jednoduchá a krásná – dodat buňkám vzduch tam, kde ho chybí.
