Nové publikace
TIVDAK® schválený FDA: cílení na tkáňový faktor u rakoviny děložního čípku
Naposledy posuzováno: 02.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Dne 29. dubna 2024 americký Úřad pro kontrolu potravin a léčiv (FDA) plně schválil přípravek TIVDAK® (tisotumab vedotin) od společnosti Seagen Inc., což je lék zaměřený na tkáňový faktor (TF), pro léčbu pacientek s rekurentním nebo metastatickým karcinomem děložního čípku, který progredoval během chemoterapie nebo po ní. To představuje významný průlom v léčbě rakoviny děložního čípku a zdůrazňuje potenciál konjugátů protilátek a léků (ADC) v onkologii.
Mechanismus účinku přípravku TIVDAK
Tivdak je ADC, který cílí na TF kombinací monoklonální protilátky tisotumab proti TF od společnosti Genmab s technologií ADC od společnosti Seagen, která je navržena tak, aby cílila na antigeny TF na rakovinných buňkách a doručovala cytotoxickou složku MMAE přímo do rakovinných buněk.
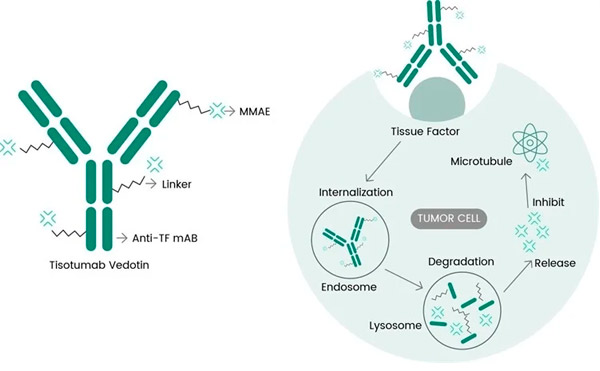
Molekulární mechanismus účinku tisotumabu vedotinu ( https://doi.org/10.3390/ijms23073559 )
TF: Perfektní cíl pro vývoj ADC
Je známo, že transkripční faktor (TF) se podílí na nádorové signalizaci a angiogenezi a je nadměrně exprimován u naprosté většiny pacientů s rakovinou děložního čípku a mnoha dalšími solidními nádory. Jeho schopnost rychlé internalizace po vazbě protilátek a minimální vliv na normální srážlivost krve dále zvyšují jeho vhodnost pro cílenou léčbu rakoviny.
