Nové publikace
Nové genetické mechanismy by mohly být terapeutickým cílem proti gliomu
Naposledy posuzováno: 02.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Studie z laboratoře Shi-Yuan Chenga, PhD., profesora na neuroonkologickém oddělení Kena a Ruth Daveyových na neurologické klinice, identifikovala nové mechanismy, které jsou základem alternativních sestřihů RNA v nádorových buňkách gliomu a mohou sloužit jako nové terapeutické cíle. Výsledky studie byly publikovány v časopise Journal of Clinical Investigation.
„Našli jsme jiný způsob léčby gliomu optikou alternativního sestřihu a objevili jsme nové cíle, které dosud nebyly identifikovány, ale jsou důležité pro malignitu gliomu,“ řekl Xiao Song, MD, PhD, docent neurologie a hlavní autor studie.
Gliomy jsou nejčastějším typem primárního nádoru mozku u dospělých a pocházejí z gliových buněk, které se nacházejí v centrálním nervovém systému a podporují sousední neurony. Gliomy jsou vysoce rezistentní vůči standardní léčbě, včetně radiace a chemoterapie, kvůli genetické a epigenetické heterogenitě nádoru, což zdůrazňuje potřebu najít nové terapeutické cíle.
Předchozí výzkum z laboratoře Cheng, publikovaný v časopise Cancer Research, ukázal, že důležitý sestřihový faktor SRSF3 je v gliomech významně zvýšený ve srovnání s normálními mozky a že sestřih RNA regulovaný SRSF3 podporuje růst a progresi gliomu ovlivňováním mnoha buněčných procesů v nádorových buňkách.
Sestřih RNA je proces, který zahrnuje odstranění intronů (nekódujících oblastí RNA) a spojení exonů (kódujících oblastí) za vzniku zralé molekuly mRNA, která podporuje genovou expresi v buňce.
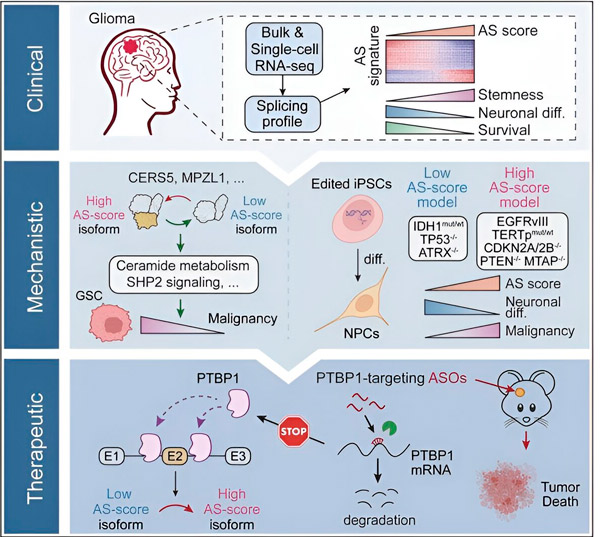
V této studii se vědci zaměřili na identifikaci změn v alternativním sestřihu v nádorových buňkách gliomu, mechanismů, které jsou základem těchto změn, a na určení jejich potenciálu jako terapeutických cílů.
Pomocí výpočetních metod a technologií sekvenování RNA vědci zkoumali změny sestřihu v nádorových buňkách gliomu odebraných od pacientů. Pro potvrzení těchto změn použili technologie genové editace CRISPR k zavedení různých mutací driveru gliomu do modelů gliomu odvozených z lidských indukovaných pluripotentních kmenových buněk (iPSC).
Zjistili, že tyto změny sestřihu jsou zesíleny variantou receptoru epidermálního růstového faktoru III (EGFRIII), o kterém je známo, že je nadměrně exprimován v mnoha nádorech, včetně gliomů, a jsou inhibovány mutací v genu IDH1.
Výzkumníci potvrdili funkci dvou sestřihových událostí RNA, které vytvářejí různé proteinové izoformy s různými aminokyselinovými sekvencemi.
„Pouze jedna z těchto izoforem může podporovat růst nádoru, na rozdíl od druhé izoformy, která je normálně exprimována v normálním mozku. Nádory využívají tento mechanismus k selektivní expresi izoformy podporující nádor oproti izoformě normálního mozku,“ řekl Song.
Tým poté analyzoval upstreamové proteiny vázající RNA a zjistil, že gen PTBP1 reguluje sestřih RNA podporující nádor v buňkách gliomu. Pomocí ortotopického modelu gliomu u imunodeficientních myší se vědci zaměřili na PTBP1 terapií založenou na antisense oligonukleotidech (ASO), která nakonec potlačila růst nádoru.
„Naše data zdůrazňují roli alternativního sestřihu RNA v ovlivňování malignity a heterogenity gliomů a jeho potenciál jako terapeutické zranitelnosti při léčbě dospělých gliomů,“ napsali autoři studie.
Dalším krokem pro výzkumníky je prozkoumat potenciál cílení na PTBP1 k vyvolání protinádorové imunitní odpovědi, uvedl Song.
„Pomocí analýzy sekvenování RNA s dlouhým čtením jsme zjistili, že cílení na PTBP1 v buňkách gliomu vede k produkci více alternativně sestřižených transkriptů, které v normálních tkáních chybí. Naším dalším projektem je tedy zjistit, zda tato izoforma může generovat některé antigeny, aby imunitní systém mohl nádor lépe rozpoznat,“ řekl Song.
Song také dodal, že jejich tým má zájem analyzovat změny sestřihu v nenádorových buňkách pacientů s gliomem, jako jsou imunitní buňky.
„Již víme, že sestřih je velmi důležitý pro regulaci funkcí v buňce, takže by měl regulovat nejen malignitu nádoru, ale může také regulovat funkci imunitních buněk a určit, zda dokáží účinně ničit rakovinu. Provádíme tedy také bioinformatické analýzy imunitních buněk infiltrovaných nádorem, abychom zjistili, zda dochází ke změně v sestřihu poté, co imunitní buňka infiltruje nádor.“
„Naším cílem je určit roli alternativního sestřihu při formování imunosupresivního nádorového mikroprostředí a identifikovat potenciální cíle pro zlepšení účinnosti imunoterapií u gliomu,“ řekl Song.
