Nové publikace
Mutace genu ARID1A zvyšuje citlivost nádorů na imunoterapii
Naposledy posuzováno: 02.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Imunoterapie v posledních letech způsobila revoluci v léčbě rakoviny. Místo přímého cílení na nádory imunoterapie směruje imunitní systém pacientů k efektivnějšímu útoku na nádory. To je obzvláště účinné u některých obtížně léčitelných druhů rakoviny. Na současnou imunoterapii však reaguje méně než polovina všech pacientů s rakovinou, což vytváří naléhavou potřebu identifikovat biomarkery, které by mohly předpovědět, kteří pacienti budou z léčby s největší pravděpodobností mít prospěch.
Vědci si nedávno všimli, že pacienti, jejichž nádory mají mutaci v genu ARID1A, s větší pravděpodobností pozitivně reagují na blokádu imunitních kontrolních bodů, což je typ imunoterapie, která funguje tak, že udržuje aktivované imunitní buňky bojující s rakovinou.
Vzhledem k tomu, že mutace genu ARID1A je přítomna u mnoha druhů rakoviny, včetně rakoviny endometria, vaječníků, kolorektálního karcinomu, žaludku, jater a slinivky břišní, vědci ze Salk Institute se zamýšleli nad tím, jak by mohla přispět k citlivosti léčby a jak by kliničtí lékaři mohli tyto informace využít k personalizaci léčby rakoviny pro každého pacienta.
Jejich nová studie, publikovaná v časopise Cell, ukazuje, že mutace ARID1A činí nádory citlivými na imunoterapii tím, že k nádoru přitahuje imunitní buňky bojující proti rakovině prostřednictvím antivirové imunitní odpovědi.
Vědci naznačují, že tato mutace a antivirová imunitní odpověď by mohly být použity jako biomarker pro lepší výběr pacientů pro specifické imunoterapie, jako je blokáda imunitních kontrolních bodů. Tato zjištění také podporují vývoj léků cílených na ARID1A a příbuzné proteiny, aby se zvýšila citlivost dalších nádorů na imunoterapii.
„To by mohlo skutečně změnit výsledek léčby rakoviny u pacientů,“ řekla docentka Diana Hargreavesová, hlavní autorka studie. „Pacienti s mutací ARID1A již mají imunitní odpověď, takže stačí ji posílit blokádou imunitních kontrolních bodů, abychom jim pomohli zničit nádory zevnitř.“
Ačkoli bylo známo, že lidé s mutacemi ARID1A dobře reagují na blokádu imunitních kontrolních bodů, přesná souvislost mezi těmito dvěma faktory zůstávala nejasná. Aby vědci ze Salkova institutu objasnili mechanismus, použili myší modely melanomu a kolorektálního karcinomu s mutací ARID1A i funkčním ARID1A.
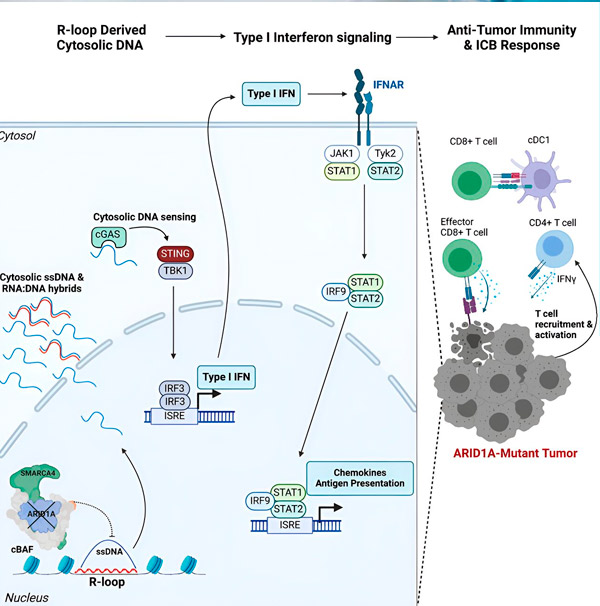
Zdroj: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Tým pozoroval silnou imunitní odpověď u všech modelů s mutací ARID1A, ale ne u těch, kde byla ARID1A funkční, což podporuje myšlenku, že mutace ARID1A tuto odpověď skutečně řídí. Jak to ale funguje na molekulární úrovni?
„Zjistili jsme, že ARID1A hraje důležitou roli v jádře tím, že udržuje správnou organizaci DNA,“ říká Matthew Maxwell, první autor studie a postgraduální student v laboratoři Hargreaves. „Bez funkčního ARID1A může být volná DNA vyříznuta a uvolněna do cytosolu, čímž se aktivuje žádoucí antivirová imunitní odpověď, kterou lze zesílit blokádou imunitních kontrolních bodů.“
Gen ARID1A kóduje protein, který pomáhá regulovat tvar naší DNA a udržovat stabilitu genomu. Když ARID1A mutuje, spustí se v rakovinných buňkách řetězec událostí podobný Rube Goldbergovi.
Zaprvé, nedostatek funkčního ARID1A vede k uvolnění DNA do cytosolu. Cytosolická DNA poté aktivuje antivirový alarmový systém, dráhu cGAS-STING, protože naše buňky jsou přizpůsobeny k označení jakékoli DNA v cytosolu jako cizí, aby se chránily před virovými infekcemi. Dráha cGAS-STING nakonec zapojuje imunitní systém do náboru T buněk do nádoru a jejich aktivace do specializovaných rakovinných T buněk.
V každém kroku, v závislosti na předchozím, vede tento řetězec událostí – mutace ARID1A, únik DNA, alarm cGAS-STING, nábor T-buněk – ke zvýšení počtu T-buněk bojujících s rakovinou v nádoru. Blokáda imunitních kontrolních bodů pak může být použita k zajištění toho, aby tyto T-buňky zůstaly aktivované, a tím se zvýšila jejich schopnost porazit rakovinu.
„Naše zjištění poskytují nový molekulární mechanismus, kterým může mutace ARID1A přispívat k protinádorové imunitní odpovědi,“ říká Hargreaves. „Na těchto zjištěních je vzrušující jejich translační potenciál. Mutace ARID1A můžeme využít k výběru pacientů pro blokádu imunitních kontrolních bodů a nyní vidíme mechanismus, kterým by léky inhibující ARID1A nebo jeho proteinový komplex mohly být použity k dalšímu posílení imunoterapie u jiných pacientů.“
Popisem mechanismu, kterým je blokáda imunitních kontrolních bodů účinnější u rakoviny s mutací ARID1A, vědci poskytují lékařům odůvodnění pro upřednostnění této imunoterapie u pacientů s mutací ARID1A. Tato zjištění jsou důležitým krokem k personalizaci léčby rakoviny a inspirují vývoj nových terapií zaměřených na ARID1A a jeho proteinový komplex.
Tým Salkova institutu doufá, že jejich zjištění do budoucna zlepší výsledky léčby pacientů s různými typy rakoviny spojenými s mutacemi ARID1A, a hodlá prozkoumat tento klinický překlad ve spolupráci s Kalifornskou univerzitou v San Diegu.
