Nové publikace
Deriváty thalidomidových sloučenin vedou ke smrti rezistentních nádorových buněk
Naposledy posuzováno: 02.07.2025

Veškerý obsah iLive je lékařsky zkontrolován nebo zkontrolován, aby byla zajištěna co největší věcná přesnost.
Máme přísné pokyny pro získávání zdrojů a pouze odkaz na seriózní mediální stránky, akademické výzkumné instituce a, kdykoli je to možné, i klinicky ověřené studie. Všimněte si, že čísla v závorkách ([1], [2] atd.) Jsou odkazy na tyto studie, na které lze kliknout.
Pokud máte pocit, že některý z našich obsahů je nepřesný, neaktuální nebo jinak sporný, vyberte jej a stiskněte klávesu Ctrl + Enter.
Studie provedená Goetheho univerzitou ve Frankfurtu poukazuje na možnost, že by deriváty thalidomidu mohly být potenciálně použity k léčbě rakoviny. Thalidomid se v 50. letech 20. století prodával jako lék na spaní. Později se stal nechvalně známým tím, že v raných fázích těhotenství způsoboval závažné vrozené vady.
Je také známo, že tato molekula označuje proteiny v buňce k destrukci. V rámci současné studie vědci vytvořili deriváty thalidomidu. Podařilo se jim prokázat, že tyto látky ovlivňují destrukci proteinů zodpovědných za přežití rakovinných buněk.
Snad žádná jiná molekula nemá tak bouřlivou minulost jako thalidomid. Byla hlavní složkou léku schváleného v mnoha zemích v 50. letech 20. století jako sedativum a lék na spaní. Brzy se však ukázalo, že těhotné ženy užívající thalidomid často rodí děti s vážnými deformacemi.
V posledních desetiletích však do něj medicína opět vkládá velké naděje. Studie mimo jiné ukázaly, že inhibuje růst cév, a je proto potenciálně vhodný k odříznutí nádorů od jejich živného média. Poté se také ukázal jako velmi účinný při léčbě mnohočetného myelomu, zhoubných nádorů v kostní dřeni.
„Nyní víme, že thalidomid lze nazvat ‚molekulárním lepidlem‘,“ vysvětluje Dr. Xinglai Cheng z Ústavu farmaceutické chemie na Goetheho univerzitě ve Frankfurtu. „To znamená, že je schopen chytit dva proteiny a spojit je dohromady.“
To je obzvláště zajímavé, protože jeden z těchto proteinů je jakýmsi „značkovacím strojem“: k jinému proteinu připojuje jednoznačnou nálepku „ODPAD“.
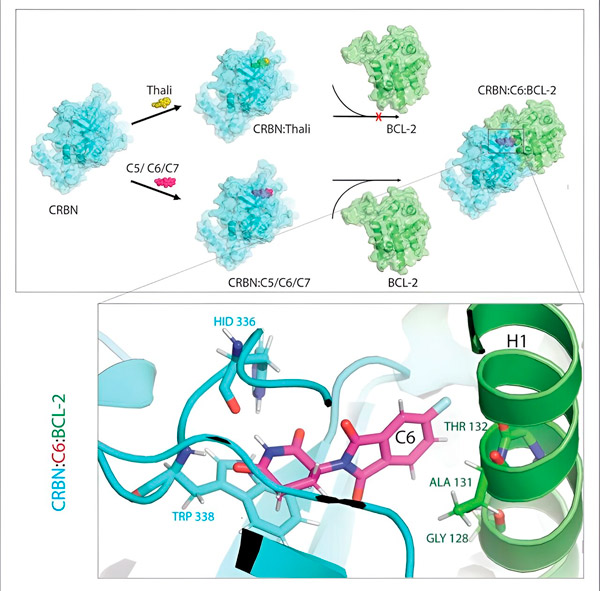
Deriváty thalidomidu C5, C6 a C7 mění CRBN, „značící stroj“, tak, aby se mohl vázat na BCL-2. Tímto způsobem je molekula BCL-2 označena pro degradaci – možná nová strategie v boji proti rakovině. Autor: Dr. Xinglai Cheng.
Systém likvidace odpadu v buňce tuto značku rozpozná: Zachytí označenou molekulu proteinu a rozdrtí ji. „Tento mechanismus vysvětluje různé účinky thalidomidu,“ říká Cheng. „V závislosti na tom, který protein je označen, může způsobit deformace během embryonálního vývoje nebo zničit maligní buňky.“
Tento mechanismus otevírá velké možnosti pro medicínu, protože rakovinné buňky jsou pro přežití závislé na určitých proteinech. Pokud by se na ně dalo systematicky cílit a drtit, možná by se nemoc dala vyléčit. Problém je v tom, že molekulární lepidlo je poměrně zvláštní.
Jedním z jeho vazebných partnerů je vždy buněčný značkovací stroj, neboli vědecky řečeno E3 ligáza zvaná CRBN. Druhým partnerem může být jen velmi málo z mnoha tisíců proteinů v těle – které z nich závisí na lepidle.
„Vytvořili jsme tedy sérii derivátů thalidomidu,“ říká Cheng. „Poté jsme testovali, zda mají adhezivní vlastnosti, a pokud ano, proti kterým proteinům jsou účinné.“ Za tímto účelem vědci přidali své deriváty ke všem proteinům v kultivované buněčné linii. Poté pozorovali, které z těchto proteinů byly následně degradovány v přítomnosti CRBN.
„Během tohoto procesu jsme identifikovali tři deriváty, které by mohly označovat buněčný protein BCL-2, který je velmi důležitý pro degradaci,“ vysvětluje Cheng. „BCL-2 brání buňkám v aktivaci jejich sebezničujícího programu, takže pokud tam není, buňky umírají.“
Proto je BCL-2 již dlouho předmětem výzkumu rakoviny. Existuje dokonce lék na leukémii zvaný venetoklax, který snižuje účinnost BCL-2 a tím způsobuje sebezničení mutovaných buněk.
„V mnoha rakovinných buňkách je však samotný BCL-2 mutovaný. V důsledku toho venetoklax již tento protein neinhibuje,“ říká Cheng. „Byli jsme schopni ukázat, že i naše deriváty signalizují degradaci této mutované formy. Naši partneři z Max Planckova institutu pro biofyziku navíc simulovali interakci derivátů thalidomidu s BCL-2 na počítači. To ukázalo, že se deriváty vážou na zcela jiná místa než venetoklax – výsledek, který jsme později byli schopni experimentálně potvrdit.“
Vědci také testovali své sloučeniny na ovocných muškách s rakovinnými buňkami. Míra přežití much ošetřených tímto způsobem byla výrazně vyšší. Cheng však varuje před přílišnými nadějemi, protože tyto výsledky jsou stále základním výzkumem. „I když ukazují, že modifikované molekuly thalidomidu mají velký terapeutický potenciál, zatím nemůžeme říci, zda se v praxi někdy osvědčí.“
Výsledky studie byly publikovány v časopise Cell Reports Physical Science.
